(BALB/c-hCTLA4,C57BL/6-hCTLA4,BALB/c hPD1/ hCTLA4,C57BL/6- hPD1/ hCTLA4)
細胞傷害性Tリンパ球抗原4(Cytotoxic T lymphocyte associated antigen-4,CTLA4)はCD152ともいわれ、CTLA4遺伝子にコード化された白血球分化抗原であり、免疫グロブリンスーパーファミリーに属しています。CTLA4遺伝子にコード化膜タンパク質は、細胞外領域が受容体/リガンド結合領域であり、細胞外領域がシグナル伝達に関与しています。
T細胞の中で主にCTLA4を発現する細胞は制御性T細胞(Treg)であり、細胞性免疫を負に調節できるT細胞の一種です。現在、CTLA4の機能は、Tregの局在を制御することであると考えられています。CTLA4の細胞外領域は、APC(抗原提示細胞)表面のB7分子リガンド(CD80/CD86)にCD28と競合的に結合し、阻害シグナルを生成し、T細胞の活性化を阻害し、腫瘍細胞をTリンパ球の攻撃から守れます。したがって、CTLA4の免疫効果を阻害することで、免疫細胞の大量増殖を促し、それによって抗腫瘍免疫反応を誘導または増強できます[1-2]。
構築戦略:集萃薬康はゲノム編集技術を利用し、BALB/c及びC57BL/6マウスのCTLA4細胞外領域を対応のヒトセグメントに置き換え、細胞内領域は完全なマウス配列を保持することで、単一ヒト化マウスBALB/c-hCTLA4とC57BL/6-hCTLA4及び二重ヒト化マウスBALB/c-hPD1/hCTLA4とC57BL/6-hPD1/hCTLA4を含むCTLA4ヒト化マウスモデルを開発しました。CTLA4ヒト化マウスモデルはヒトCTLA4阻害剤の薬力学的評価と安全性評価のための理想的な動物モデルです。
1. BALB/c-hCTLA4:YERVOY®の薬力学的実験
CT26.WT腫瘍細胞株をBALB/c-hCTLA4マウスモデルに皮下接種した後、抗ヒトCTLA4抗体であるYERVOY®(lpilimumab)の腫瘍抑制効果試験を実施しました。
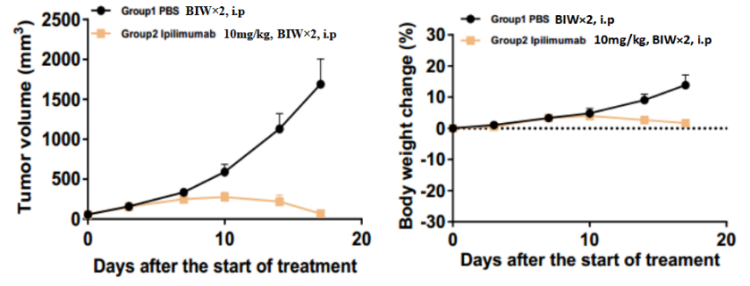
左図:マウス腫瘍増殖グラフ 右図:マウス体重変化グラフ
BALB/c-hCTLA4マウスへのCT26.WT皮下接種モデルに基づくin vivo薬力学的実験。マウス結腸癌細胞CT26.WTをBALB/c-hCTLA4ヒト化マウスに皮下移植し、腫瘍平均体積が約100 mm3になったときに、無作為に対照群と治療群(n=7)に分け、対応の治療薬で治療を行いました。週に2回、計4回投与しました。データはMean±SEMで示されたものです。
試験結果:抗ヒトCTLA4抗体であるYervoyは腫瘍増殖に対し非常に有意な抑制作用が認められました。
考察:BALB/c-hCTLA4マウスはヒトCTLA4抗体のin vivo薬力学的効果を評価するための効果的なツールです。
2. BALB/c-hCTLA4:YERVOY®用量の薬力学的検証
CT26.WT腫瘍細胞株をBALB/c-hCTLA4マウスモデルに皮下接種した後、抗ヒトCTLA4抗体であるYERVOY®(lpilimumab)の腫瘍抑制効果試験を実施しました。
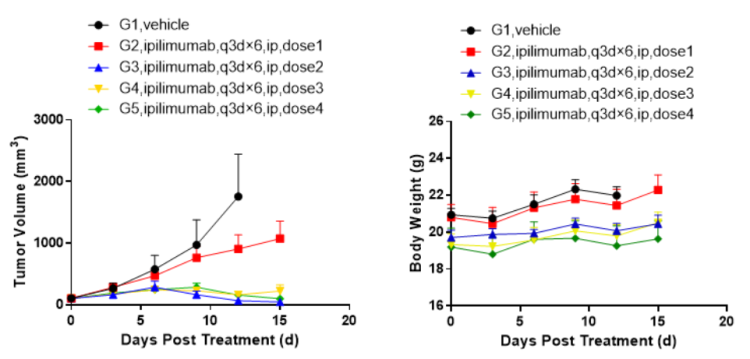
左图:小鼠肿瘤生长曲线 右图:小鼠体重变化曲线
左図:マウス腫瘍増殖グラフ 右図:マウス体重変化グラフ
BALB/c-hCTLA4マウスへのCT26.WT皮下接種モデルに基づくin vivo薬力学的実験。マウス結腸癌細胞CT26.WTをBALB/c-hCTLA4ヒト化マウスに皮下移植し、腫瘍平均体積が約100 mm3になったときに、無作為に対照群(G1)と治療群(G2-G5)に分けました。データはMean ± SEMで示されたものです’。
試験結果:抗ヒトCTLA4抗体Yervoyは高用量治療群(G3:TGI=96%; G4:TGI=91%;G5:TGI=87.5%)で、腫瘍増殖に対し非常に有意な抑制作用が認められたが、低用量治療群では一部の抗腫瘍効果(TGI=39.6%)が認められました。
考察:BALB/c-hCTLA4マウスはヒトCTLA4抗体のin vivo薬力学的効果を評価するための効果的なツールです。
3. C57BL/6-hCTLA4:YERVOY®の薬力学的実験
MC38腫瘍細胞株をB6-hCTLA4マウスに皮下接種した後、抗ヒトCTLA4抗体であるYERVOY®(lpilimumab)の腫瘍抑制効果試験を実施しました。

左図:マウス腫瘍増殖グラフ 右図:マウス体重変化グラフ
B6-hCTLA4マウスへのMC38皮下接種モデルに基づくin vivo薬力学的試験。マウス結腸癌細胞MC38をB6-hCTLA4ヒト化マウスに皮下移植し、腫瘍平均体積が約100 mm3になったときに、無作為に対照群と治療群(対照群n=5,治療群n=7)に分け、対応の治療薬で治療を行いました。3日に1回、計6回投与しました。データはMean±SEMで示されたものです。
試験結果:抗ヒトCTLA4抗体であるYervoyは腫瘍増殖に対し非常に有意な抑制作用が認められました(TGI=100%)。
考察:B6-hCTLA4マウスはヒトCTLA4抗体の薬力学的効果を評価するための理想的なモデルです。
4. C57BL/6-hCTLA4:YERVOY®用量の薬力学的検証
MC38腫瘍細胞株をB6-hCTLA4マウスモデルに皮下接種した後、抗ヒトCTLA4抗体であるYERVOY®(lpilimumab)の腫瘍抑制用量反応関係試験を実施しました。

左図:マウス腫瘍増殖グラフ 右図:マウス体重変化グラフ
B6-hCTLA4マウスへのMC38皮下接種モデルに基づくin vivo薬力学的試験。マウス結腸癌細胞MC38をB6-hCTLA4ヒト化マウスに皮下移植し、腫瘍平均体積が約100 mm3になったときに、動物を対照群(G1,N=6)と治療群(G2-G3,N=6; G4-G5,N=5)に分けました。データはMean±SEMで示されたものです。
試験結果:抗ヒトCTLA4抗体Yervoyは高用量治療群(G3:TGI=85%;G4:TGI=99%;G5:TGI=99%)で、腫瘍増殖に対し非常に有意な抑制作用が認められたが、低用量治療群では一部の抗腫瘍効果(TGI=22%)が認められました。
考察:B6-hCTLA4マウスはヒトCTLA4抗体のin vivo薬力学的効果を評価するための効果的なツールです。
5. BALB/c-hPD1/hCTLA4による化合物の抗腫瘍効果評価
CT26.WT腫瘍細胞株をBALB/c-hPD1/hCTLA4マウスモデルに皮下接種した後、抗ヒトCTLA4抗体であるYERVOY®(lpilimumab)及び抗ヒトPD1抗体であるKERTRUDA®の腫瘍抑制効果評価試験を実施しました。
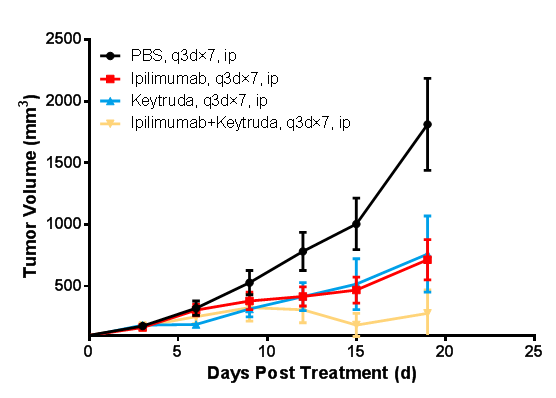
マウス腫瘍増殖グラフ
BALB/c-hPD1/hCTLA4マウスへのCT26.WT皮下接種モデルに基づくin vivo薬力学的実験。対数増殖期の結腸癌細胞CT26.WTを6-8週齢のBALB/c-hPD1/hCTLA4ヒト化マウスに皮下接種し、腫瘍増殖平均体積が約100 mm3になったときに、無作為にPBS群、lpilimumabとKeytruda単剤投与群及びlpilimumabとKeytrudaの併用群(n=7)に分け、対応の治療薬で治療を行いました。3日に1回、計7回投与しました。データはMean±SEMで示されたものです。
試験結果:lpilimumabとKeytruda単剤投与群の腫瘍増殖抑制率(TGI)はそれぞれ59.38%、50.52%で、lpilimumabとKeytruda併用群のTGIは87.45%で、すべて腫瘍の増殖に有意な抑制作用が認められました。
考察:BALB/c-hPD1/hCTLA4マウスはヒトCTLA4抗体、PD-1抗体及び併用薬の抗腫瘍効果を評価するための理想的な動物モデルです。
6. C57BL/6-hPD1/hCTLA4による化合物の抗腫瘍効果評価
MC38腫瘍細胞株をB6-hPD1/hCTLA4マウスモデルに皮下接種した後、抗ヒトCTLA4抗体であるYERVOY®(lpilimumab)及び抗ヒトPD1抗体であるOpdivo®の腫瘍抑制効果評価試験を実施しました。

マウス腫瘍増殖グラフ
6-hPD1/hCTLA4マウスへのMC38皮下接種モデルに基づくin vivo薬力学的試験。対数増殖期の結腸癌細胞MC38を6-8週齢のB6-hPD1/hCTLA4ヒト化マウスに皮下接種し、腫瘍増殖平均体積が約100 mm3になったときに、Control群、lpilimumab群、Opdivo群及びlpilimumabとOpdivo併用群 (n=5)に分け、対応の治療薬で治療を行いました。3日に1回、計6回投与しました。データはMean±SEMで示されたものです。
試験結果:lpilimumab群、Opdivo群及びlpilimumabとOpdivo併用群の腫瘍増殖抑制率(TGI)はそれぞれ42.10%,69.77%と87.19%でした。単剤群及び併用群はすべて腫瘍の増殖にある程度の抑制作用をもっており、かつ併用群の抗腫瘍効果はもっと高かったです。
考察:B6-hPD1/hCTLA4マウスはヒトCTLA4抗体、PD-1/PD-L1抗体及び併用薬または二重特異性抗体の抗腫瘍効果を評価するための理想的な動物モデルです。
参考文献
[1] Therapeutic use of anti-CTLA-4 antibodies. Int Immunol. 2015, 27(1):3-10.
[2] Blockade of CTLA-4 on both effector and regulatory T cell compartments contributes to the antitumor activity of anti‒CTLA-4 antibodies. J Exp Med. 2009,3;206(8):1717-25.