PCSK9は既知の分泌因子として、細胞膜におけるLDLRの発現レベルを負に調節できます。PCSK9は主に肝組織に発現されます。分泌されたPCSK9がLDLRと結合し、リソソームの作用により分解されます。ヒトPCSK9遺伝子に関する研究では、PCSK9の機能獲得型変異は家族性脂質異常症と関連しており、PCSK9の機能喪失型変異のLDL-Cレベルは一般集団より15%~28%低いことが示されています。したがって、PCSK9はコレステロール代謝経路における重要な調節因子です。PCSK9の発現レベルまたは活性を抑制することで、「悪玉」LDL-Cのレベルを有意に低下させることによって、PCSK9は脂質異常症治療薬の開発のための効果的な標的です。
系統:B6/JGpt-Pcsk9em1Cin(hPCSK9)/Gpt
動物使用量:8~10匹/群,3~5群
実験段階:8~10週間
1.1 研究概覧
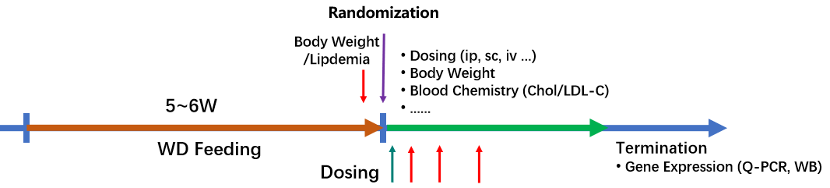
図1. B6-hPCSK9マウス研究概覧。B6-hPCSK9マウスは高コレステロール食餌の投与により、脂質異常症を発症できる。
1.2 hPCSK9ヒト化モデル検証データ
(1)hPCSK9 mRNA及びmPCSK9 mRNA測定

図2. B6-hPCSK9マウス(5週齢)の肝臓では、ヒト由来PCSK9 mRNAだけが発現され、マウスPCSK9 mRNAは発現されなかった。データはMean±SD、n=8で示されたものである。
(2)hPCSK9タンパク質レベル測定

図3. B6-hPCSK9マウスの肝臓ではhPCSK9タンパク質を検出したが、C57BL/6Jマウス(5週齢)の肝臓では検出できなかった。
(3)LDLRタンパク質レベル測定
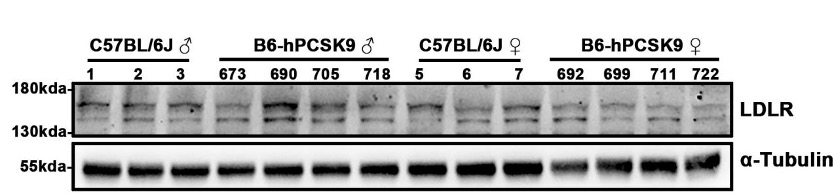
図4. C57BL/6JとB6-hPCSK9マウス(5週齢)の肝臓におけるLDLR発現には有意差が認められなかった。
(4)LDL-Cレベル測定

図5. C57BL/6JとB6-hPCSK9マウス(8週齢)血漿LDL-Cレベルに有意差が認められなかった。
1.3 hPCSK9ヒト化モデルの薬力学的試験データ
(1)薬物(evolocumab)介入により、食餌誘発性hPCSK9ヒト化マウスの血中脂質レベルが低下させた
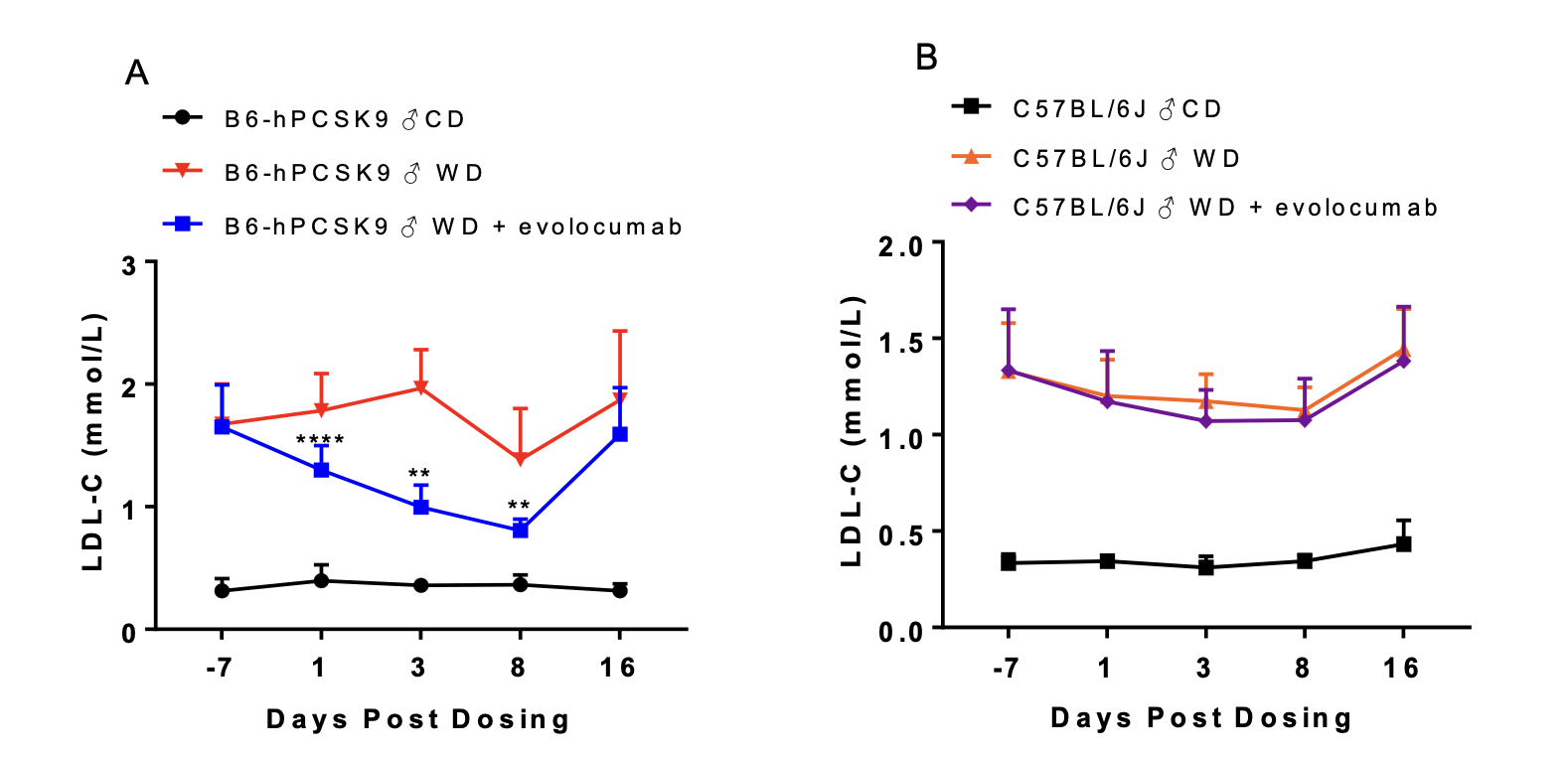
図6. 1回のexvolocumab(20mpk)尾静脈注射により、西洋型食餌を投与されたB6-hPCSK9マウスの血漿LDL-Cレベルが有意に低下させたが、西洋型食餌を投与されたC57BL/6Jマウスには、同様な効果が認められなかった。unpaired two-tailed Student's t-test法で統計学的分析を行った。**,p<0.01;***,p<0.001 対照B6-hPCSK9+WDとの比較。
(2)exvolocumabは食餌誘発性hPCSK9ヒト化マウスのLDLRレベルを有意に上昇させた
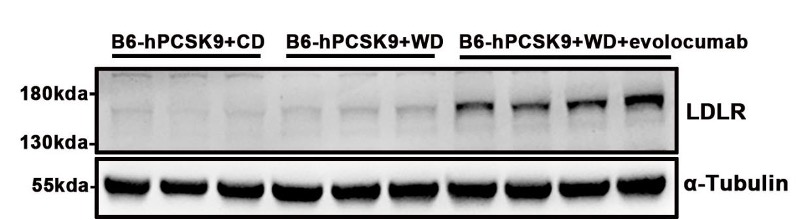
図7. 1回のevolocumabモノクローナル抗体(20mpk)を尾静脈注射した3日後、西洋型食餌を投与されたB6-hPCSK9マウスの肝臓LDLRの発現レベルは有意に上昇させた。
(3)試験薬物検証データ

図8. 試験薬物X(siRNAターゲットhPCSK9)はB6-hPCSK9高血糖マウスの血漿LDL-Cレベルを有意に低下させた。データはMean±SD、n=5で示されたものである。unpaired two-tailed Student's t-test法で統計学的分析を行った。**,P<0.01;***,P<0.001。
関連系統: