系統名:Inducible liver injury-NCG
系統タイプ:Knock-in
系統番号:T004968
系統背景:NOD/ShiLtJGpt
肝臓は生体の中で薬剤の解毒・代謝を行う最も主要な器官であり、肝臓ヒト化マウスの肝細胞はヒト特異的代謝酵素を発現でき、前臨床薬剤代謝研究において、ヒトでの薬剤の代謝経路をよりリアルに反映し、薬剤の前臨床PK/PD精度を高め、ヒト実験における薬剤の安全リスクを低減します。
集萃薬康は、重度免疫不全のNCGバックグラウンドマウスで誘導性肝障害マウスモデルInducible liver injury-NCGを作製しました。通常の給餌では肝障害を起こさず、誘発する薬剤を投与して初めて肝障害が発生し、この時点でヒト肝細胞の移植が許容されます。ヒト由来初代肝細胞を肝障害マウスモデル体内に移植して、肝臓ヒト化マウスモデルhHeps-NCGを構築します。
hHeps-NCGマウスはヒト肝細胞移植を受けた3週間後に、血清中からヒトアルブミン(hALB)の発現を検出でき、9週間後にヒト由来の肝臓再構築率が最大70%まで達しました。ヒト化マウスの肝臓では、ヒト肝臓特異的代謝酵素の発現を検出することができます。
hHeps NCGマウスは、薬剤代謝研究およびウイルス性肝炎、特にHBV関連の研究に使用でき、肝疾患の病理学的研究、ワクチンや新薬開発、およびヒト肝細胞代謝機能のインビボ研究のために信頼できる研究ツールを提供します。
1. Inducible liver injury-NCGマウスは予想される肝障害を発症することができます
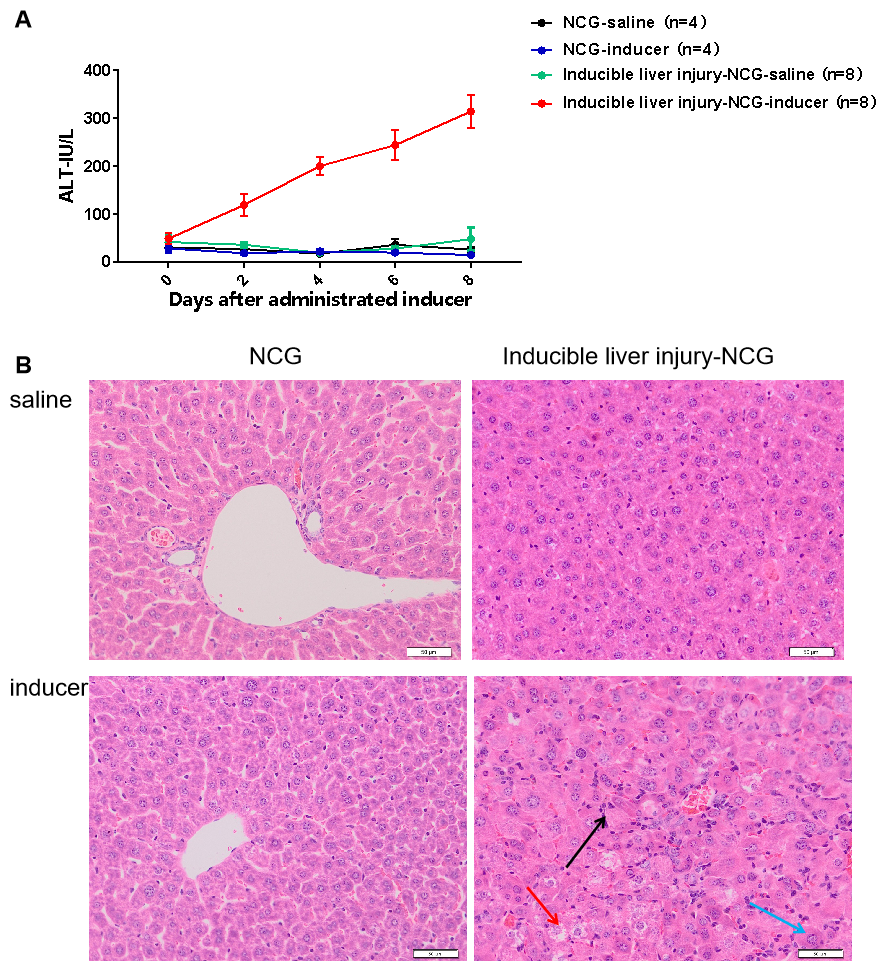
図1 Inducible liver injury-NCGマウスの肝障害誘導後の血液生化学的および肝臓病理学的検出。
その結果、通常の条件下では、Inducible liver injury-NCGマウスの肝臓に障害が生じませんでしたが、誘導薬の投与後に肝臓損傷が生じる可能性があることが示されました。
2. hHeps-NCGマウスモデルの特徴
2.1 hHeps-NCGは60%の再構築率を達成でき、末梢血中のヒトアルブミンは数mg/mLのレベルに達することができます。
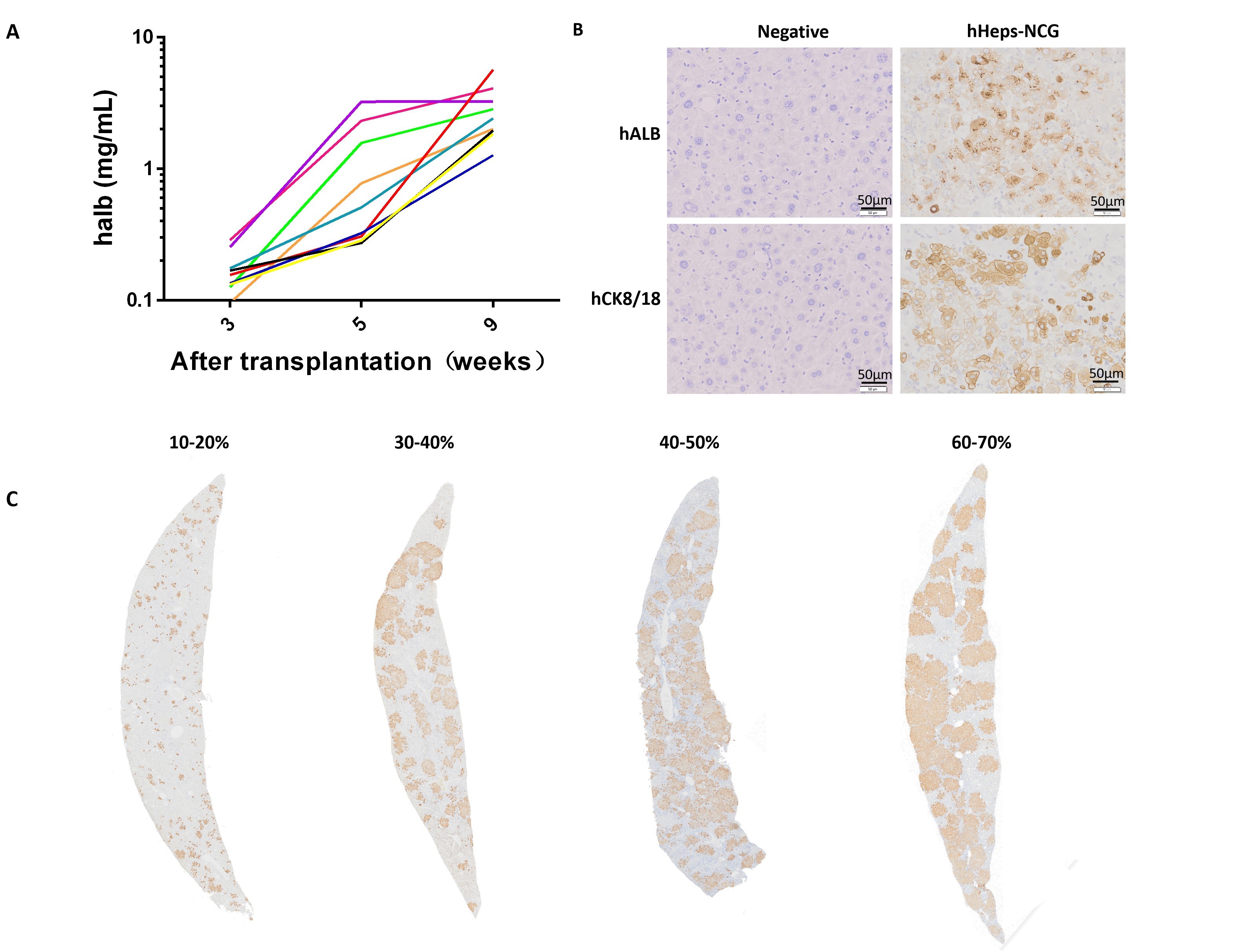
図2 hHeps-NCGマウスにヒト肝細胞を移植した後のアルブミン発現の検出。
hHeps-NCGマウスはヒト肝細胞移植を受けた3w後、血清中からヒトアルブミンの発現を検出でき、かつアルブミンレベルが週齢とともに増加しました。肝細胞移植の9w後、ヒトアルブミンレベルは5mg/mLに達することができます(図A)。肝臓組織では、ヒトアルブミン(hALB)およびCK8/18タンパク質の発現を検出できます(図B)。再構築率が異なるマウス肝臓組織スライスでは、茶色っぽいシグナルが多いほど、再構築率が高くなります(図C)。
2.2 hHeps-NCGマウスの肝臓ではヒト特異的代謝酵素を発現できます
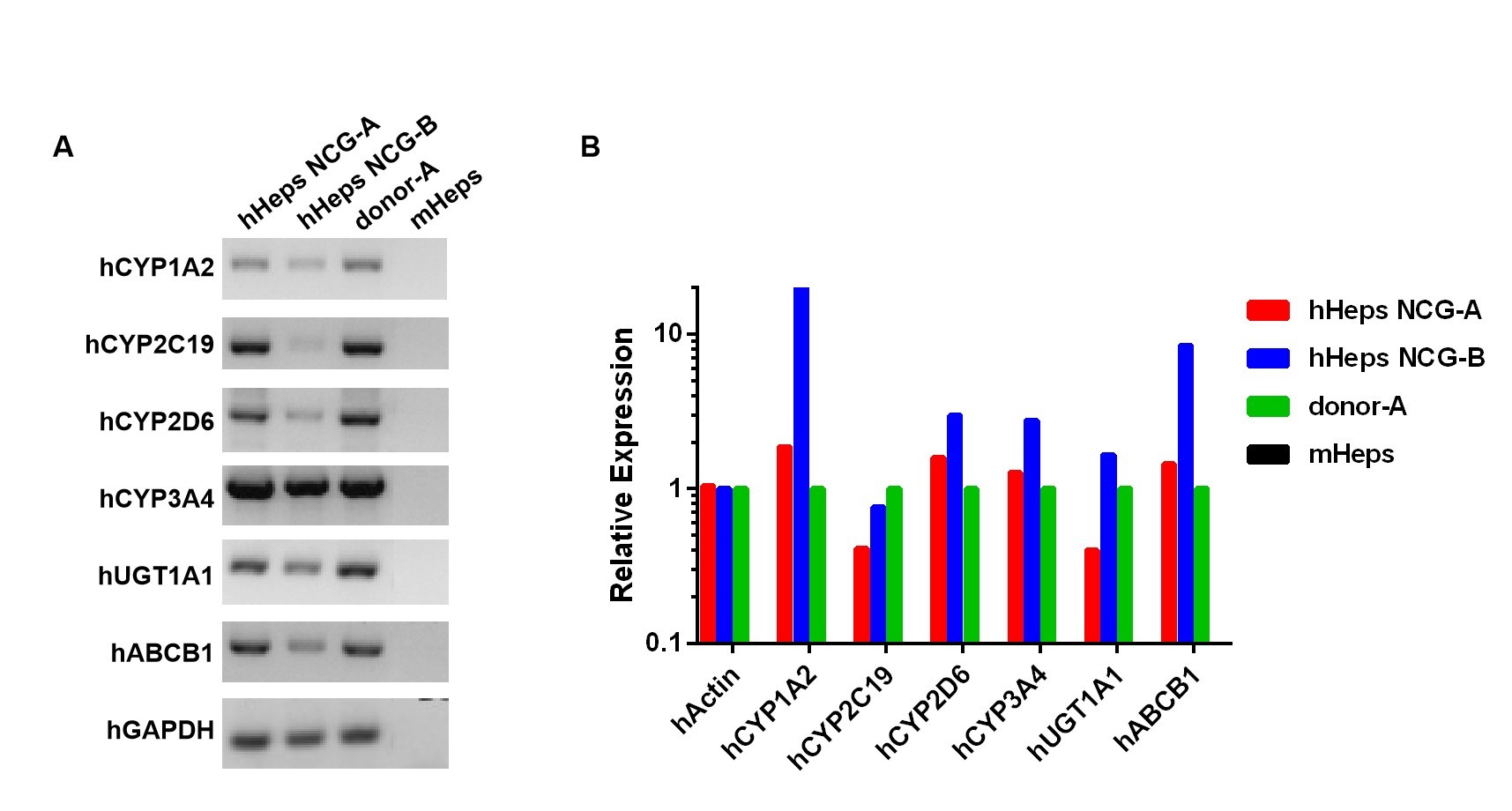
図3 hHeps-NCGマウスの肝臓におけるヒトの特異的な代謝酵素遺伝子の検出。
その結果、hHeps-NCGマウスの肝臓がヒト肝臓特異的代謝酵素を発現できることが示されました。
[1] Bray, Freddie, et al. "Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries." CA: a cancer journal for clinicians 68.6 (2018): 394-424.
[2] Xiao, Jia, et al. "Global liver disease burdens and research trends: analysis from a Chinese perspective." Journal of hepatology 71.1 (2019): 212-221.
[3]https://www.who.int/zh/news-room/fact-sheets/detail/hepatitis-b.AccessedSeptember 18, 2020.
[4] http://biodiscover.com/news/industry/737107.html
[5] https://zhuanlan.zhihu.com/p/150546400
[6] TURRINI P, SASSO R, GERMONI S, et al. Development of humanized mice for the study of hepatitis C virus infection; proceedings of the Transplantation proceedings, F, 2006 [C]. Elsevier.
[7] KATOH M, SAWADA T, SOENO Y, et al. In vivo drug metabolism model for human cytochrome P450 enzyme using chimeric mice with humanized liver[J]. Journal of pharmaceutical sciences, 2007, 96(2): 428-437.
[8] TATENO C, YOSHIZANE Y, SAITO N, et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs[J]. The American journal of pathology, 2004, 165(3): 901-912.
[9] Tateno C, Kawase Y, Tobita Y, et al. Generation of novel chimeric mice with humanized livers by using hemizygous cDNA-uPA/SCID mice[J]. PLoS One, 2015, 10(11).
[10] SONG X, GUO Y, DUO S, et al. A mouse model of inducible liver injury caused by tet-on regulated urokinase for studies of hepatocyte transplantation[J]. The American journal of pathology, 2009, 175(5): 1975-1983.
[11] http://www.vitalstar.com.cn/Index/lists/catid/81.html[J].
[12] HASEGAWA M, KAWAI K, MITSUI T, et al. The reconstituted ‘humanized liver’in TK-NOG mice is mature and functional[J]. Biochemical and biophysical research communications, 2011, 405(3): 405-410.
[13] AZUMA H, PAULK N, RANADE A, et al. Robust expansion of human hepatocytes in Fah−/−/Rag2−/−/Il2rg−/− mice[J]. Nature biotechnology, 2007, 25(8): 903-910.