结直肠癌是全球前三大癌症之一,并且结直肠癌肝转(CRCLM)移是最主要的致死原因。结直肠癌肝转移主要原因是血源性传播,癌细胞通过血管进入循环系统,并在肝脏形成转移灶。肿瘤内渗是血源性转移的关键步骤,在此期间肿瘤细胞侵入血管周围细胞外基质(ECM),突破内皮屏障并进入血液循环。在这个过程中,入侵的肿瘤细胞接触内皮细胞和免疫细胞形成肿瘤转移微环境(TMEM)。肿瘤周细胞(TPCs)作为癌组织的守门员,它是一种收缩细胞,在毛细血管内壁上包裹住内皮细胞,进而调节血管的通透性和稳定性。然而,周细胞在肿瘤血源性传播的过程中功能还存在很多争议。
为了探究肿瘤周细胞在结直肠癌肝转移中的重要作用,近日,来自暨南大学张冬梅团队等,在GUT杂志上合作发表文章Novel TCF21high pericyte subpopulation promotes colorectal cancer metastasis by remodeling perivascular matrix,他们通过单细胞测序(scRNA-seq)技术,检测了来自伴或不伴肝转移结直肠癌患者的肿瘤周细胞,发现了这类细胞的高异质性,进而鉴定出13个不同的TPCs亚群。
进一步,该团队鉴定出新的亚群TCF21highTPCs,这类亚群使血管周围ECM硬化,胶原重排,基底膜降解,帮助建立了一种血管周围易转移的微环境,煽动结直肠癌肝转移。机制上,他们发现integrin α5抑制了FAK/PI3K/AKT/DNMT1通路,从基因组上降低了TCF21的DNA甲基化,促进了该基因表达,形成了新的亚群TCF21highTPCs,加速了结直肠癌肝转移。

该团队首先发现了基质周细胞与结直肠癌肝转移有非常明显的相关性,进而发现TCF21在该类群中调控活性最高,此外,在肝转移的病人中TCF21+TPCs明显增多。为了进一步研究TCF21在周细胞中的功能,作者分别在细胞中过表达和敲降TCF21,发现TCF21的水平与细胞增殖,迁移呈负相关。紧接着,他们用RNA-seq和ChIP-Seq发现ECM信号通路富集,提示TCF21对基质-周细胞形成十分重要。ECM的重塑为肿瘤转移提供一种环境,基质-周细胞中的TCF21诱导血管周围ECM重塑并促进直肠癌细胞通过血管向周围侵袭。
为了研究TCF21在直肠癌肝转移发病过程中的功能,作者利用诱导表达的小鼠模型在体内周细胞中特异性敲除Tcf21,发现周细胞中TCF21比较特异的影响结直肠癌转移,而不影响肿瘤生长和上皮-间充质细胞转化的过程。
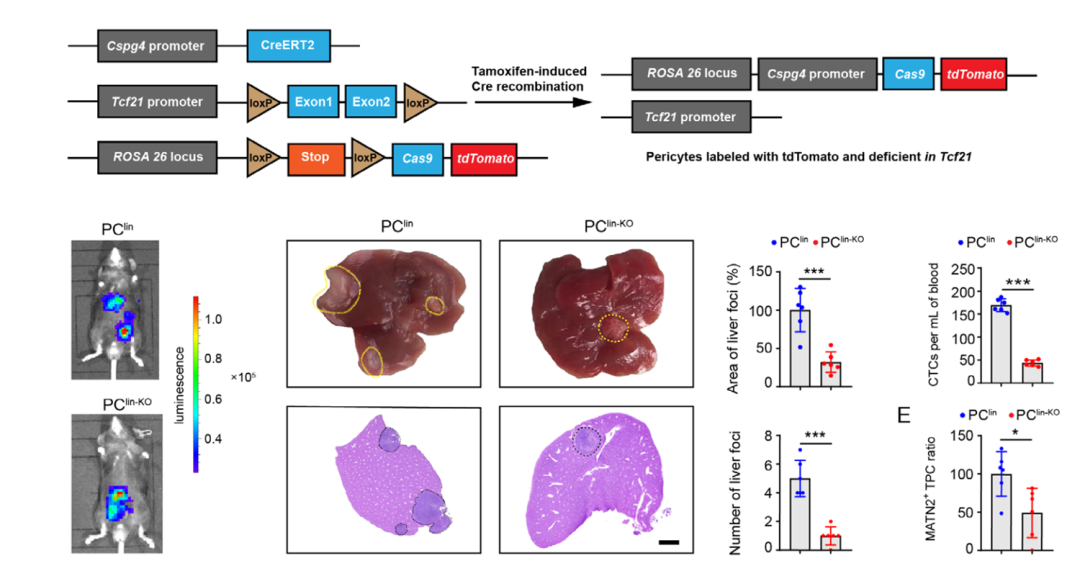
图1.体内周细胞特异性敲除Tcf21抑制直肠癌肝转移
前面研究发现TCF21能够影响ECM重塑从而影响直肠癌的迁移,这个过程具体发生了怎样的变化呢?作者发现ECM中关键组分Integrin α5在TCF21high细胞中表达很低,此外,该工作发现Integrin α5是通过调控Tcf21基因启动子区域的甲基化来调控该基因表达。更为重要的是,作者在病人的样本中发现,肝转移病灶中的胶原酶,蛋白酶相关基因表达上调,Integrin α5的水平与TCF21在周细胞中呈显著的负相关,这些结果都提示了周细胞中的Integrin α5下调导致TCF21High这一基质-周细胞亚群的形成,重塑了直肠癌周围ECM环境,为血源性转移提供了基础,加速了肝转移的发生。
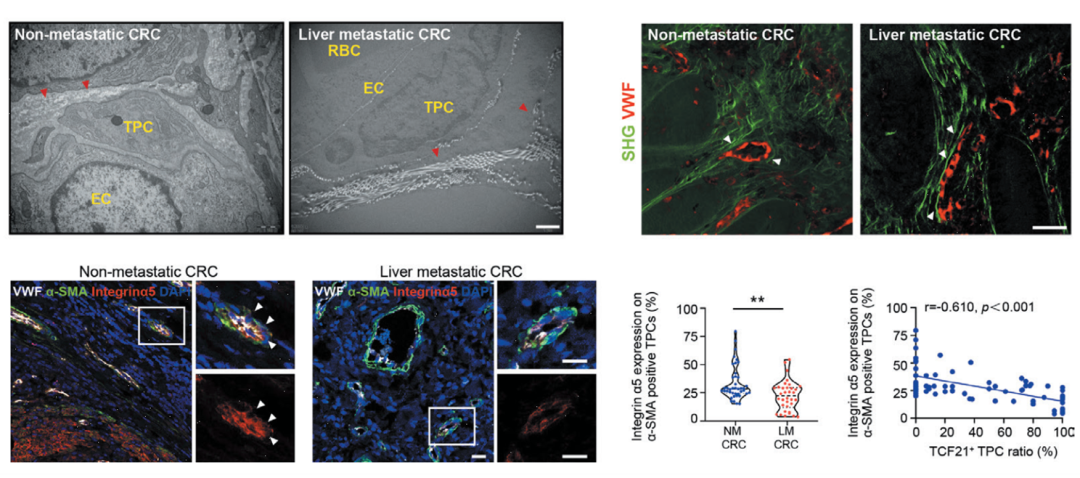
图2.人直肠癌样本中Integrin α5与TCF21+TCPs明显负相关
总之,本研究通过scRNA-seq发现了作为结直肠癌的守门员周细胞的异质性,并鉴定出肝转移相关的TCF21highTPCs新亚群。这类亚群高表达TCF21,重塑了直肠癌血管外周ECM环境,为肝转移提供条件。该工作鉴定出新的周细胞亚群,为直肠癌肝转移血源性转移提供了一个潜在的诊断标志物和新的治疗靶点。
原文链接:https://gut.bmj.com/content/early/2022/09/06/gutjnl-2022-327913