系統名:NOD/ShiLtJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt
系統タイプ:Knock out
系統番号:T001475
系統背景:NOD/ShiLtJGpt
1.系統紹介
NCG(NOD/ShiLtJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt)は、遺伝子編集技術を使用してNOD/ShiltJGptマウスのPrkdc(Protein kinase, DNA activated, catalytic polypeptide)及びIl2rg(Common gamma chain receptor)遺伝子をノックアウトすることによって得られる重症免疫不全系統です。NOD/ShiltJGptの遺伝的背景により、この系統は補体系、マクロファージ欠損などの自然な免疫欠損を持ち、かつ、この背景SirpaはヒトCD47に対して高い親和性を持っているため、NOD/ShiltJGptは、他の系統よりもヒト由来移植片(例えば、腫瘍やヒト細胞)のコロニー形成に適しています。Prkdc遺伝子の機能欠失により、V(D)J組換えが正常に行われなくなり、T細胞とB細胞の発生・成熟が阻害されます。IL2RGは、複数種類のインターロイキンサイトカインレシピエントの共通サブユニットであり、IL2RGを不活性化すると、6種類の異なるサイトカインシグナル伝達経路が失われ、NK細胞の欠損が生じます。したがって、NCGはこれまで免疫系の最も完全に欠損したマウスモデルの1つであり、ヒト由来腫瘍細胞移植(CDX)、ヒト由来腫瘍組織移植(PDX)、ヒト末梢血単核細胞(PBMC)、およびヒト由来造血幹細胞(CD34 + HSC)移植による免疫再構築に非常に適しています。NCGの生存期間は長く(>89週間)、長期の移植と薬力学的評価に役に立ちます。
2. 応用分野
(1) ヒト免疫再構築マウスモデル、例えば、BLTヒト化マウス、PBMCヒト化マウスおよびCD34+ヒト化マウス;
(2) ヒト由来腫瘍細胞、腫瘍組織移植(CDX、PDX);
(3) 薬力学的評価(小分子、高分子、併用薬);
(4) ヒトの癌モデル;
(5) 幹細胞研究。
3. 検証データ
(1) NCG免疫細胞グループ化検出図
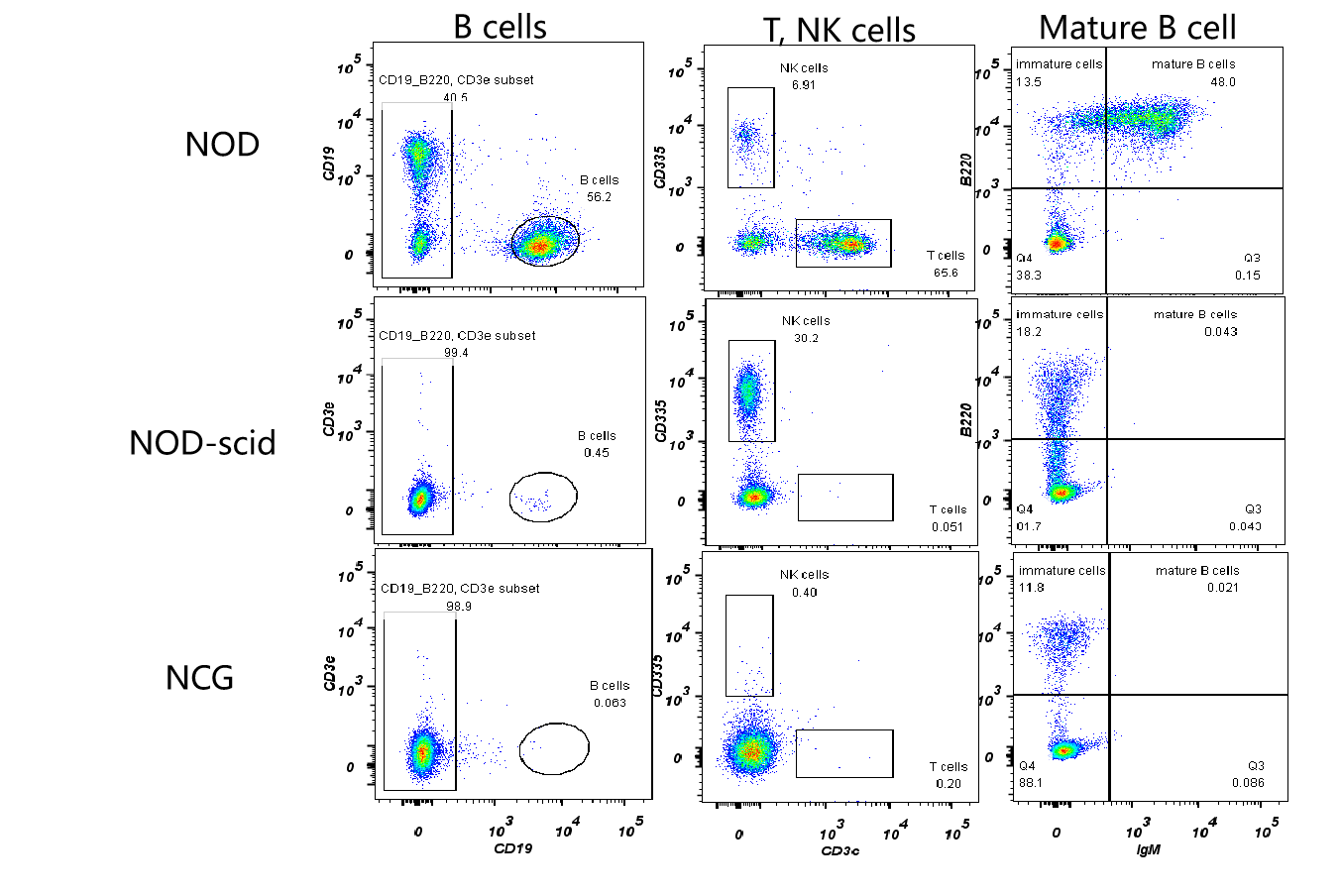
図1 NOD(NOD / ShiltJGpt)、NOD-scidおよびNCGマウスにおけるT/B/NK細胞比例の検出
5週齢のNOD(NOD/ShiltJGpt)、NOD-scidおよびNCG雌マウスの脾臓細胞を採取してフローアッセイを行い、それらのT細胞(CD3+)、B細胞(CD19+)、NK細胞(CD335)および成熟B細胞(IgM+)の比例をを測定しました。その結果、NODと比較して、NOD-scidはT、B細胞がほとんどなく、NK細胞の比例が代償的に増加したことが示されました。NODと比較して、NCGはT、B、NK細胞がほとんどなく、免疫不全がNOD-scidよりも徹底的です。
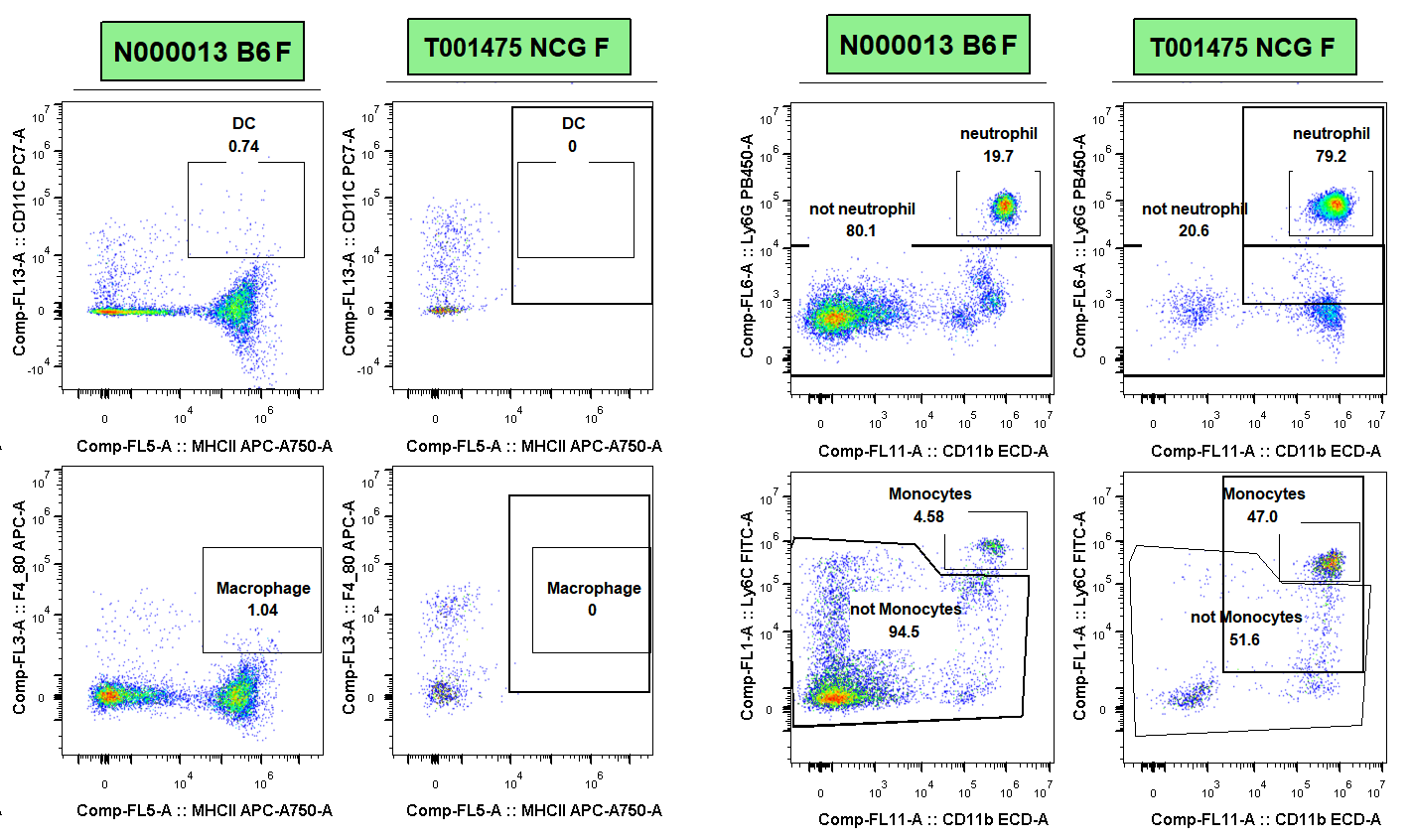
図2 C57BL/6およびNCGマウスにおけるMacrophage/Neutrphil/Monocytes細胞比例の検出
5週齢のC57BL/6およびNCG雌マウスの脾臓細胞を採取してフローアッセイを行い、そのDC細胞(CD11c)、Macrophage細胞(F4/80)、Neutrphil細胞およびMonocytes細胞の比例を測定しました。その結果、C57BL/6と比較して、NCGはDC、Macrophage細胞をほとんど検出せず、Neutrphil細胞とMonocytes細胞の比例が代償的に増加したことが示されましたを。
4. CDXにおけるNCGマウスの適用
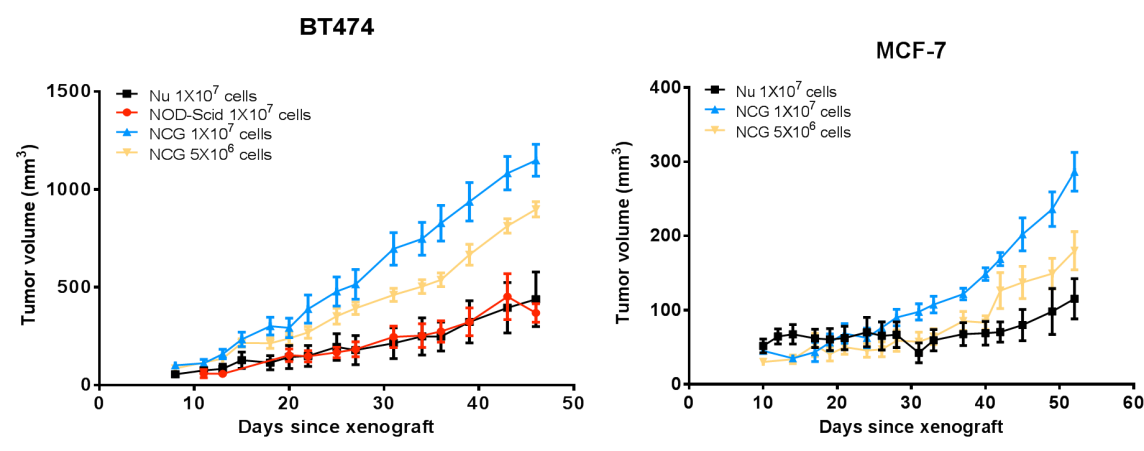
図3 Nu/Nod-scid/NCGマウスにおけるヒト乳がん細胞株BT474およびMCF-7の腫瘍形成性試験
対数増殖期のヒト乳癌細胞株BT474およびMCF-7を6~8週齢のNu/Nod-scid/NCGマウスに皮下接種し、腫瘍サイズは経時的に勾配曲線で増加しました。(腫瘍体積の数値はMean±SEMで示されました)
5. PDXにおけるNCGマウスの適用
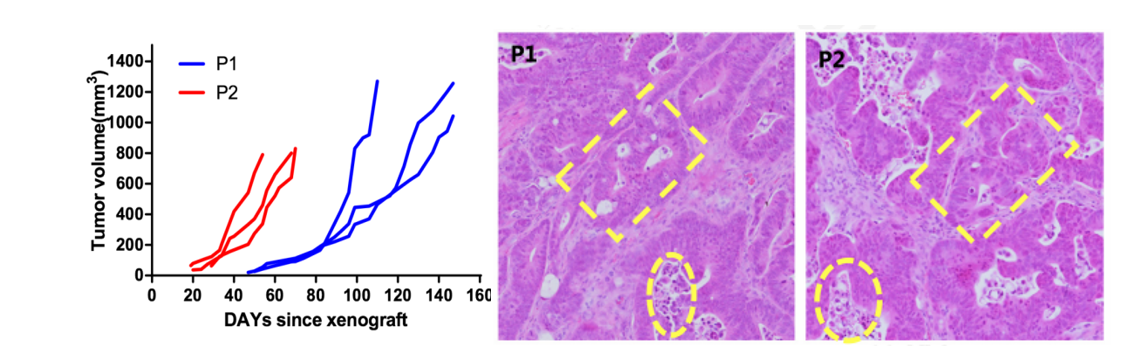
図4 NCGマウスにおける結腸癌肝転移(PDX)の腫瘍形成性試験、およびPDX標本スライスの構造
P1:患者の腫瘍組織をNCGマウスに接種して増殖させた第1世代モデル;P2:P1世代の腫瘍モデルを他のNCGマウス体内に継代させた第2世代モデル。パンクチャーサンプル頭数が少なく、増殖速度が遅いため、P2世代の増殖速度が有意に上がりました。PDX標本の継代の間では、高度に分裂している細胞型が保持されました。
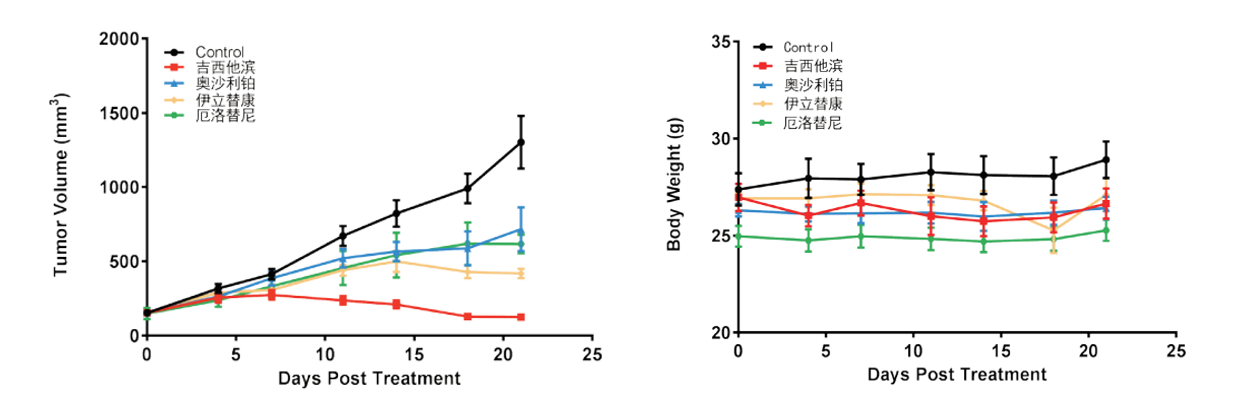
図5 結腸癌肝転移の接種に基づくNCGマウスの薬効テスト
対照群G1と比較して、ゲムシタビン治療群、イリノテカン治療群の腫瘍重量はいずれも有意に減少しました。
6. 免疫再構築
免疫系化マウスとは、重度の免疫不全マウス(NCGなど)体内にヒトの造血細胞、リンパ球または組織を移植することで得られたヒト免疫系を有するマウスモデルを指すもので、huPBMC-NCGとhuHSC-NCGマウスが含まれています。免疫系ヒト化マウスとCDXまたはPDXモデリングの組み合わせは、ヒト免疫系環境における腫瘍増殖研究、腫瘍治療プランの評価に利用でき、特に免疫治療に基づく新薬開発に役に立ちます。
(1)huPBMC-NCG
huPBMC-NCGマウスは、ヒト末梢血単核細胞(Peripheral Blood Mononuclear Cell, PBMC)を重度の免疫不全マウスNCGに移植することにより、ヒト免疫系を再構築するNCGマウスモデルです。NCGマウスでのhuPBMCの免疫再構築は、効率が高く、速度が速く、再構築後にリンパ系T細胞をメインとし、複数の種類の腫瘍免疫薬剤の評価に使用できます。huPBMC-NCGマウス免疫再構築後の生存周期は5-7週間で、医薬品投与周期が割に短いです。T細胞の再構築速度が非常に速いため、ヒト由来T細胞はマウス組織を識別、攻撃し、それによって移植片対宿主病(GvHD)を発症するので、このモデルをGvHD薬剤の評価に利用できます。huPBMCドナー間の明らかな違いにより、異なるドナーからのPBMCの実験結果に対する影響を排除するために、Donorのスクリーニングを通じてhuPBMC-NCG免疫再構築の安定性を保証する必要があります。

図6 huPBMC-NCGマウスの生存曲線
それぞれドナーFとドナーGからのhuPBMCをNCGマウスに注射し、huPBMC-NCG免疫再構築マウスの生存期間を分析しました。移植されたPBMCは異種免疫細胞であるため、huPBMC-NCGマウスは時間の経過とともにGvHDを発症し、huPBMC-NCGマウスの使用ウィンドウ期間が短くなりました。この研究では、NCGマウスがhuPBMCの移植1ヶ月前後で相次いで死亡したことがわかりました。

図7 huPBMC-NCGにおける免疫再構築のレベル
フローサイトメトリーでhuPBMC-NCGマウスのヒト化過程での末梢血におけるヒト白血球割合を検出しました。時間の経過とともに、huPBMC-NCGマウスの末梢血中のヒト白血球の比例は徐々に増加し、3週目に平均的なヒト白血球割合が50%を超えました。huPBMC-NCGの免疫再構築は速度が速く、再構築された細胞が主にCD3+T細胞でした。データはMean±SEMで示されました。
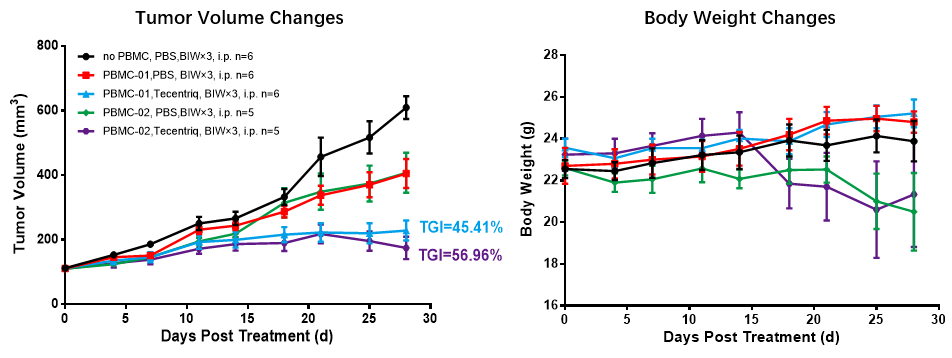
図8 huPBMC-NCGマウスに基づいたインビボ薬効試験
![]()
![]() それぞれ2種類の異なるDonor由来のhuPBMC細胞でhuPBMC-NCGを構築し、PDL1高発現細胞株MDA-MB-231を接種し、皮下担がんモデルを構築しました。PBMC接種後、MDA-MB-231のNCG体内での腫瘍形成速度に影響を及ぼします。腫瘍が平均体積約100mm3まで成長したとき、Vehicle(対照)群およびTecentriq投与群にランダムに分けられ、適切な薬剤で治療しました。毎週2回、3週間連続して投与しました。その結果、Tecentriqが腫瘍成長を有意に阻害したことが示されました(PBMC-01、TGI = 45.41%; PBMC-02、TGI = 56.96%)。データはMean±SEMで示されました。
それぞれ2種類の異なるDonor由来のhuPBMC細胞でhuPBMC-NCGを構築し、PDL1高発現細胞株MDA-MB-231を接種し、皮下担がんモデルを構築しました。PBMC接種後、MDA-MB-231のNCG体内での腫瘍形成速度に影響を及ぼします。腫瘍が平均体積約100mm3まで成長したとき、Vehicle(対照)群およびTecentriq投与群にランダムに分けられ、適切な薬剤で治療しました。毎週2回、3週間連続して投与しました。その結果、Tecentriqが腫瘍成長を有意に阻害したことが示されました(PBMC-01、TGI = 45.41%; PBMC-02、TGI = 56.96%)。データはMean±SEMで示されました。
huPBMC-NCGマウスに基づくインビボGvHD薬効研究
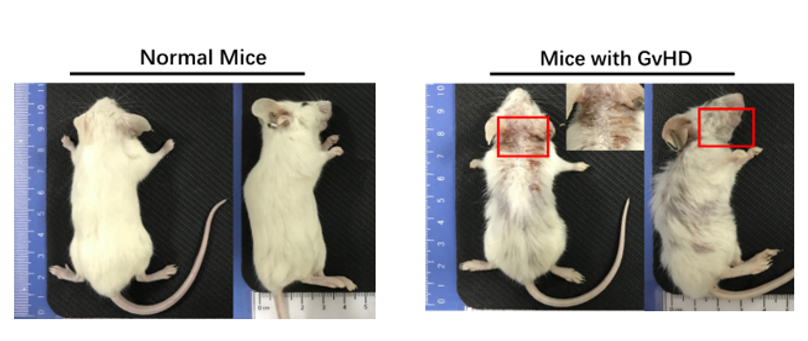
図9 マウスは再構築後、GvHD表現型、アーチ型の背中、毛髪の吹き出しを示しました
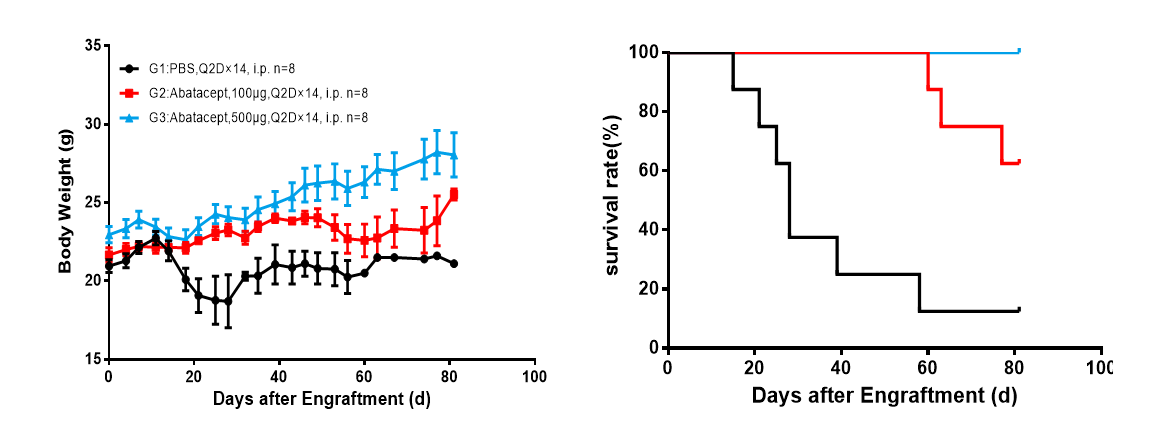
図10 huPBMC-NCGマウスに基づいたGvHD薬剤の評価
huPBMCの尾静脈を照射処理されたNCGマウス(照射はGvHDの反応を加速できます)に移植し、GvHD薬を投与して治療を行いました。その結果、GvHD薬剤はhuPBMC-NCGマウスの生存期を伸ばし、かつ投与量の増加に伴い、生存期を有意に伸ばし、体重を増やすことが認められました。
(2)huHSC-NCG
huHSC-NCGマウスは、ヒト造血幹細胞(CD34 + HSC)を照射された骨髄破壊性の重度免疫不全マウスNCGに移植し、分化させてT細胞、B細胞、NK細胞など様々な造血系細胞あるいは免疫系細胞を生じさせ、それによって免疫系のヒト化モデルを得、再構築された免疫細胞タイプはPBMCヒト化マウスと比較して豊富です。NCGマウスをレシピエントマウスとして用い、huHSC-NCGヒト化マウスを構築しました。
NCGマウスにCD34+HSCを移植した後、huPBMCと比較して、再構築速度が遅く、GvHDの発生が遅れ、生存サイクルが39週間を超え、投与ウィンドウ期間が延長されました。huHSC-NCGマウスの免疫再構築は効率が高く、主にT細胞や多数の未成熟B細胞、および少量のNK細胞やマクロファージなどを再構築し、腫瘍免疫治療薬剤の評価に利用できます。

図11 huHSC-NCGマウスヒト化モデルの実験設計のフローチャート
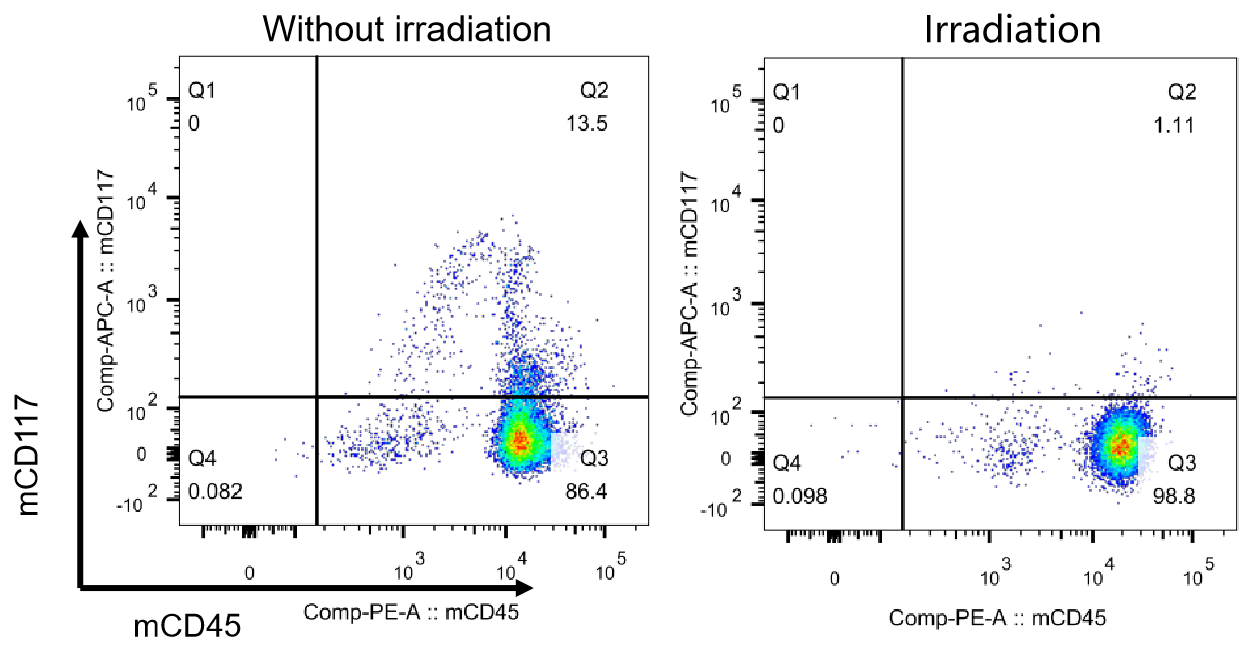
図12 NCGマウスにおける骨髄破壊効果の検出
フローサイトメトリーで照射による骨髄破壊効果を検出します。照射によりマウスの骨髄中の造血幹細胞を除去することができ、それによってヒト化HSC移植後の再構築レベルを向上させることができます。照射後、mCD45+mCD117+細胞集団の割合は1.11%であり、非照射群(13.5%)と比較して有意に低いです。
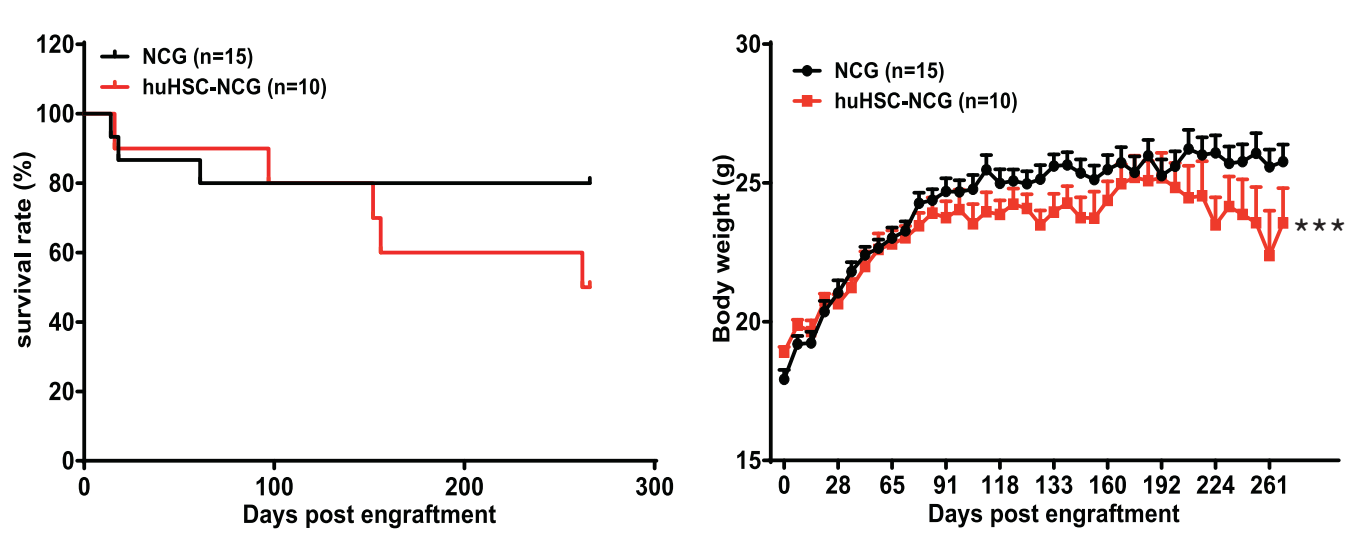
図13 HuHSC-NCGマウスの生存曲線および体重変化状況
左図は、huHSC-NCGマウスが37週間以上生存でき、生存率がNCG野生型マウスと有意差がないことを示しています。右図のhuHSC-NCGマウスの体重は時間とともに増加傾向を示し、NCG野生型マウスの体重と有意差がありませんでした。
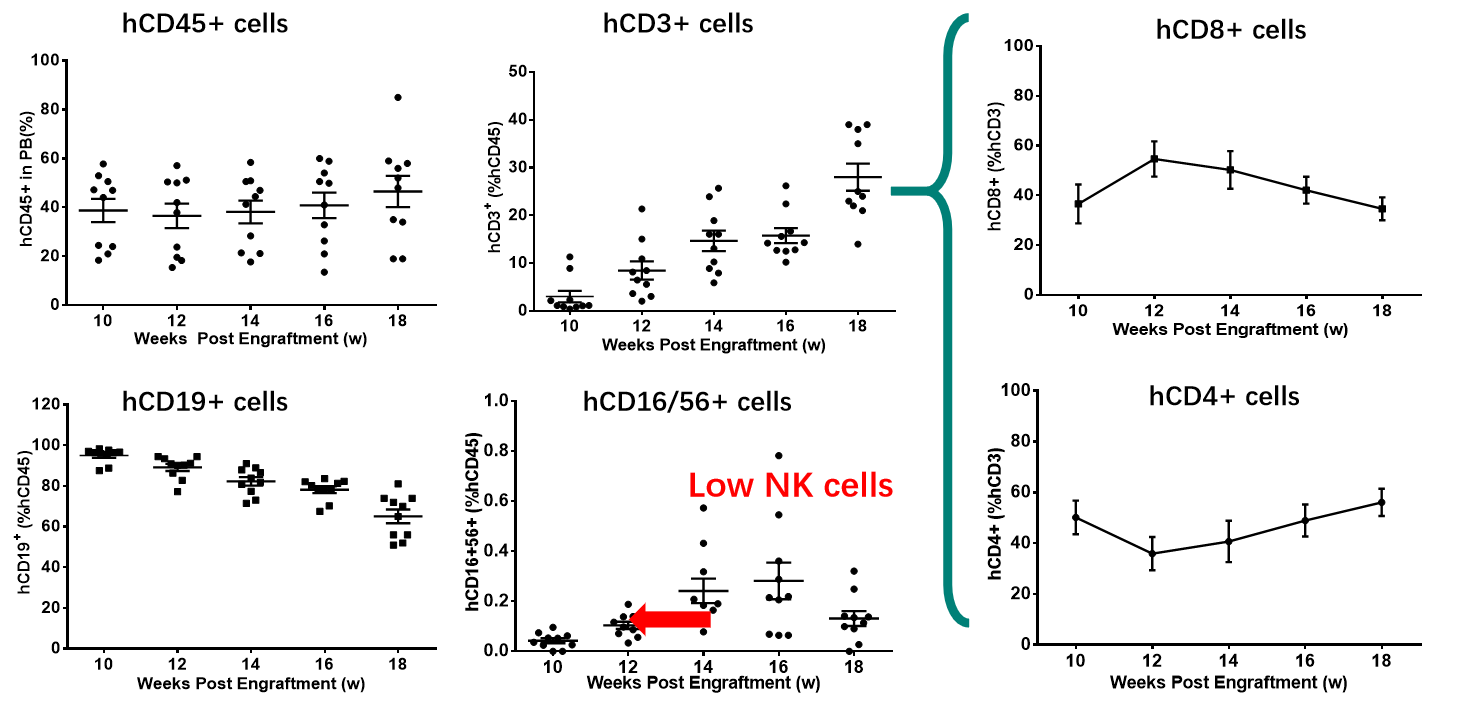
図14 huHSC-NCGの再構築効果の同定
huHSC-NCGマウスの免疫再構築は効率が高く、主にT細胞や多数の未成熟B細胞、および少量のNK細胞を再構築します。
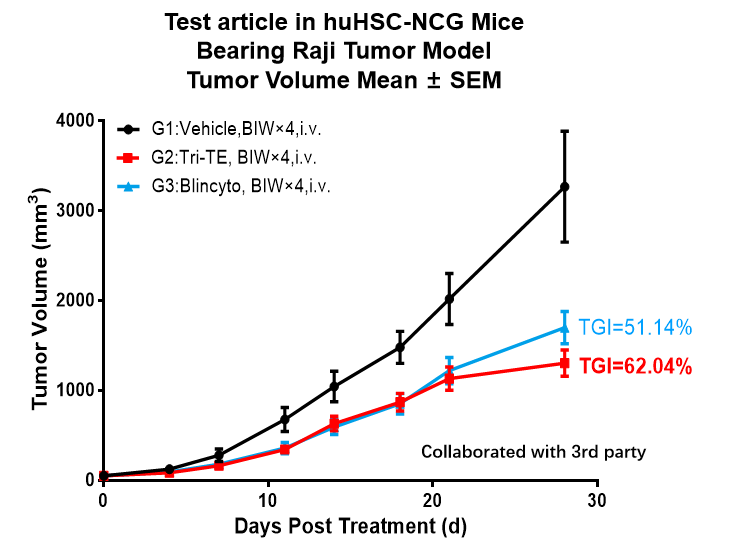
図15 huHSC-NCGマウスモデルに基づいたインビボ薬効評価
huHSC-NCGマウスに基づいたインビボ治療薬試験。対数増殖期のヒトリンパ腫細胞Raji細胞をhuHSC-NCGマウスに皮下接種し、腫瘍が平均体積約40-50 mm3に増殖した時点で、Vehicle群、Tri-TE投与群、Blincyto投与群にランダムに分け、適切な薬を使用して治療を行いました。その結果、Tri-TE群(TGI = 62.04%)およびBlincyto投与群(TGI = 51.14%)が、huHSC-NCGRaji細胞担癌マウスの腫瘍増殖に対して抑制効果を持っていることが示されました。
7. NCGのCAR-T治療における適用
キメラ抗原受容体T細胞療法(Chimeric Antigen Receptor T Cell,CAR-T)は、腫瘍の養子免疫療法の新しい方法です。CAR-T細胞は腫瘍抗原のターゲット認識能力があり、抗原提示なしで腫瘍細胞を殺すことができ、これまでの免疫療法と比較して、高い特異性と持続的な攻撃などの利点があります。悪性腫瘍、特に血液腫瘍の治療において高い効果を果たしています。集萃薬康は、豊富なCDXおよび独立した知的財産権を持つPDXバンクを備えており、複数種類の固形腫瘍や血液腫瘍を含み、CAR-T薬効評価用の豊富な腫瘍モデルリソースを提供しています。かつ、集萃薬康は、末梢血中のCAR-T細胞の絶対カウント法とサイトカインの検出方法を開発しており、CAR-T実験的検出のニーズを満たことができます。
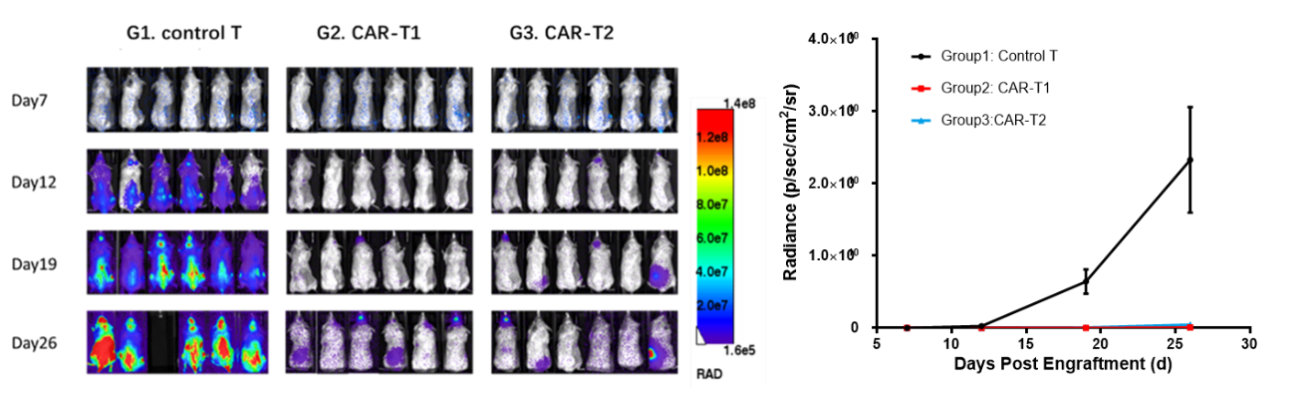
Nalm6-Luciferase細胞をNCGマウスに尾静脈接種した後、7日目に腫瘍負荷に応じてグループ分けし、それぞれControl T、CAR-T1およびCAR-T2細胞治療を行い、D12、D19、D26にインビボイメージング技術で腫瘍負荷を検出しました。インビボイメージングおよび統計結果によると、Control Tと比較して、CAR-T1およびCAR-T2細胞はいずれもマウスインビボでの腫瘍増殖をよく抑制し、マウスの生存期間を延長することができることが確認されました。
8. NCGマウスの増殖曲線
9.血液ルーチン
Hematology | |||
Parameter | Units | 18W(♂) | 18W(♀) |
WBC | 103 cells/mm3 | 0.81 | 1.22 |
RBC | 106 cells/mm3 | 9.06 | 8.92 |
HB | g/L | 125.10 | 124.20 |
HCT | % | 50.95 | 50.71 |
MCV | fL | 56.14 | 56.82 |
MCH | Pg | 13.83 | 13.93 |
MCHC | g/L | 246.40 | 245.40 |
RDW | % | 18.72 | 18.07 |
PLT | 103 cells/mm3 | 780.80 | 564.78 |
MPV | fL | 4.35 | 4.53 |
NE# | 103 cells/mm3 | 0.48 | 0.56 |
NE% | % | 60.55 | 51.32 |
LY# | 103 cells/mm3 | 0.28 | 0.54 |
LY% | % | 33.33 | 40.35 |
EO# | 103 cells/mm3 | 0.01 | 0.05 |
EO% | % | 1.57 | 3.25 |
MO# | 103 cells/mm3 | 0.03 | 0.06 |
MO% | % | 3.96 | 4.31 |
BA# | 103 cells/mm3 | 0.00 | 0.01 |
BA% | % | 0.60 | 0.77 |
10. 血液生化学
Biochemistry | |||
Parameter | Units | 18W(♂) | 18W(♀) |
ALT | IU/L | 50.00 | 29.77 |
AST | IU/L | 126.80 | 130.36 |
TP | g/L | 37.95 | 34.90 |
ALB | g/L | 2.19 | 1.69 |
AKP | IU/L | 56.75 | 54.20 |
TBIL | μmol/L | 66.20 | 91.53 |
BUN | μmol/L | 10.38 | 12.47 |
CREA | μmol/L | 20.31 | 30.15 |
CHOl | mmol/L | 0.98 | 0.84 |
TG | mmol/L | 1.69 | 1.18 |
HDL-C | mmol/L | 39.75 | 47.50 |
LDL-C | mmol/L | / | / |
Ca | mmol/L | 2.37 | 2.28 |
P | mmol/L | 3.04 | 2.51 |
Fe | μmol/L | 2.48 | 1.88 |
GLU | mmol/L | 7.06 | 5.46 |
11. フロー細胞
Flow cytometr | |||||
Parameter | Units | spleen | blood | ||
8W/♂ | 8W/♀ | 8W/♂ | 8W/♀ | ||
B cells | % of leukocytes | 0.90 | 0.29 | 0.23 | 0.23 |
NK cells | 0.42 | 0.83 | 0.54 | 0.86 | |
T cells | 0.86 | 0.41 | 0.43 | 1.43 | |
immature B | % of B cells | 97.20 | 99.00 | / | / |
mature B | 2.80 | 1.00 | / | / | |
CD4+ T | % of T cells | 0.12 | 0.00 | 0.00 | 0.00 |
CD8+ T | 0.12 | 0.00 | 0.00 | 0.00 | |
12. 発表された文献
1. Lee S et al. (2017) Clodronate improves survival of transplanted hoxb8 myeloid progenitors with constitutively active GMCSFR in immunocompetent Mice. Methods&clinical development. 7, 60-73.【NCG】
2. Wen H J et al. (2018) Recurrent ECSIT mutation encoding V140A triggers hyperinflammation and promotes hemophagocytic syndrome in extranodal NK/T cell lymphoma. Nature Medicine, 24, 154-164.【NCG】
3. Cao Z W et al. (2017) Targeting the vascular and perivascular niches as a regenerative therapy for lung and liver fibrosis. Science Translational Medicine, 9(405), eaai8710.【NCG】
4. M Poggio et al. (2019) Suppression of exosomal PD-L1 induces systemic anti-tumor immunity and memory. Cell. 177(2): 414-427.【NCG】
5. Ludwik KA et al. (2018) ERα-Mediated Nuclear Sequestration of RSK2 Is Required for ER+ Breast Cancer Tumorigenesis. Tumor Biology and Immunology, 10.1158/0008-5472.【NCG】
6. Juan H et al. (2019) IRF-7 Is a Critical Regulator of Type 2 Innate Lymphoid Cells in Allergic Airway Inflammation.Cell Reports. 29: 2718-2730.【NCG】
7. Shultz L D et al. (1995). "Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice". J. Immunol. 154 (1): 180-91. 【NCG】
8. Takenaka K et al. (2007). "Polymorphism in Sirpa modulates engraftment of human hematopoietic stem cells". Nat. Immunol. 8 (12): 1313-23. 【NCG】
9. Greiner D L et al. (1998). "SCID mouse models of human stem cell engraftment". Stem Cells. 16 (3): 166-177. 【NCG】
10. Cao X et al. (1995). "Defective lymphoid development in mice lacking expression of the common cytokine receptor gamma chain". Immunity. 2 (3): 223-38.【NCG】
11. Wang Z Y et al. (2019) Salinomycin exerts anti‐colorectal cancer activity by targeting the β‐catenin/T‐cell factor complex. Br J Pharmacol. 176(17): 3390-3406.【NCG】
12. Guo J L et al. (2018) Humanized mice reveal an essential role for human hepatocytes in the development of the liver immune system. Cell Death Dis. 9(6): 667.【NCG】
13. Zhang D P et al. (2020) The Agpat4/LPA axis in colorectal cancer cells regulates antitumor responses via p38/p65 signaling in macrophages. Signal Transduction and Targeted Therapy. 5, 24.【NCG】
14. Yin S X et al. (2018) Runx3 Mediates Resistance to Intracellular Bacterial Infection by Promoting IL12 Signaling in Group 1 ILC and NCR+ILC3. Front Immunol. 9: 2101.【NCG】
15. Targeting the Lnc-OPHN1-5/Androgen Receptor/hnRNPA1 Complex Increases Enzalutamide Sensitivity to Better Suppress Prostate Cancer Progression(2019)【NCG】