特应性皮炎(atopic dermatitis, AD)又称特应性湿疹,是最常见的慢性疾病之一,其发病率高、病程慢、反复发作且难以根治。其中最突出的临床特征是反复发作的局部瘙痒及湿疹,使患者陷入“越抓越痒”的恶性循环。此外还可能伴随皮肤干燥和干皮症等其他皮肤病,或合并全身过敏性疾病,如伴有过敏性鼻炎、哮喘等疾病,因此AD通常被认为是一种系统性的自免疾病[1, 2]。

特应性皮炎最早在1930s被系统性的描述,并被命名为特应性皮炎,其中“特应性”(希腊词atopos)原意为“without place,无法解释的”,现衍生为“遗传相关的对环境因素过敏”[1]。特异性皮炎通常在儿童时期首发,并可反复发作持续到成年,也可以在任何年龄段首次发病。AD的病程以连续持续长时间发作,或以“发作-缓解-复发”的形式出现[2]。疾病的早发、病程严重程度、家族史、早期过敏原致敏等都是AD发病的危险因素。
根据Global Burden of Disease (GBD)研究显示,在过去30年(1987-2017),全球范围的AD患病率逐年增加,其中发达国家中AD的患者占比多达1/5[1]。来自美国的两项研究报告称,2013年儿童和成人的直接和间接费用总计高达每人每年3300美元。近年来我国的AD患者数量呈逐年上升趋势,AD已发展成为皮肤科常见的难治性皮肤病。
目前报道的AD发病的直接诱因有很多种,包括遗传和环境因素、皮肤屏障功能障碍、微生物失衡、免疫失调、皮肤炎症与环境间的互作等等,均在特应性皮炎的发病中发挥重要作用(图1)[4]。

图1:多种多样的AD发病诱因[4]
一般认为,AD发病的首要特征是皮肤屏障的改变和外界抗原的入侵[5]。皮肤是人体的第一道防线,能够有效的抵御物理化学、微生物等侵害。有关特应性皮炎易感性研究显示,表皮屏障的破坏可以由多种因素引起,例如环境温湿度、过敏原、物理化学刺激、抓挠和FLG(表皮聚丝蛋白)基因突变等等[6]。而微生物失调会进一步破坏屏障,常见的有金黄色葡萄球菌和马拉色菌的定植感染[4, 5]。
表皮屏障破坏是AD发展的第一步,AD的另一个突出特征是表皮免疫系统的失调。遗传因素和外源因素的不同组合引发的皮肤功能改变和外界抗原的入侵,引起皮下组织免疫系统的激活。免疫系统的激活通常是固有免疫的首先激活,涉及到树突细胞、巨噬细胞、嗜中性粒细胞等,而随着皮下免疫系统的反复激活,最终将逐渐形成不可逆的慢性炎症,这与适应免疫的激活有关。其中,Th2细胞及其相关炎性因子的激活被认为是AD炎症表型的最主要通路(图2):活化的Th2细胞将细胞因子释放到皮肤中,主要是IL-4、IL-13和IL-31,激活B细胞和浆细胞促进炎症和抗原特异性IgE的产生,进一步削弱屏障功能引发瘙痒[7, 8]。

图2:AD发病机制中的表皮免疫系统失调[8]
临床上AD治疗的目的是缓解或消除临床症状,消除诱发因素,减少和预防复发,减少或减轻合并症,提高患者的生活质量。但AD的完全消除和避免复发往往很难实现。
控制皮损和抑制免疫系统过度激活是AD治疗的主要作用靶点。2020年的新版AD治疗共识指出:外用糖皮质激素(TCS)仍是AD的一线疗法。普遍的治疗手段包括[9]:
1. ①健康教育,使用保湿润肤剂,避免或回避诱发因素(非特异因素、过敏原回避等);
2. ②根据皮损及部位选择外用糖皮质激素(TCS)和钙调磷酸酶抑制剂(TCI)对症治疗;
3. ③口服抗组胺药治疗合并过敏症(荨麻疹、过敏性鼻炎)或止痒;
4. ④对症抗微生物感染治疗;
5. ⑤重度患者的免疫抑制剂(如环孢素、甲氨蝶呤)治疗;
6. ⑥新兴的靶向疗法(如度普利尤单抗)。
需要指出的是,目前还没有任何一款针对AD治疗的特效药物。现有AD治疗药物多为广谱类药物,大面积或长期使用往往带来多种明显的副作用,如皮肤萎缩、免疫系统障碍、生长发育异常等[9, 10]。
随着AD发病机制的细致探究,多种AD发病的分子基础逐渐得到系统性阐述,其中有针对性的疗法(如针对屏障异常、瘙痒通路、特定免疫信号分子、家族性基因型)的发展可以为特应性皮炎的个性化治疗开辟一个充满希望的新时代[7, 11, 12]。集萃药康为助力AD药物创新和研发,已成功构建多种特应性皮炎AD小鼠模型,并提供临床前AD药物评价的技术服务。
(1)自免药物临床前一站式服务
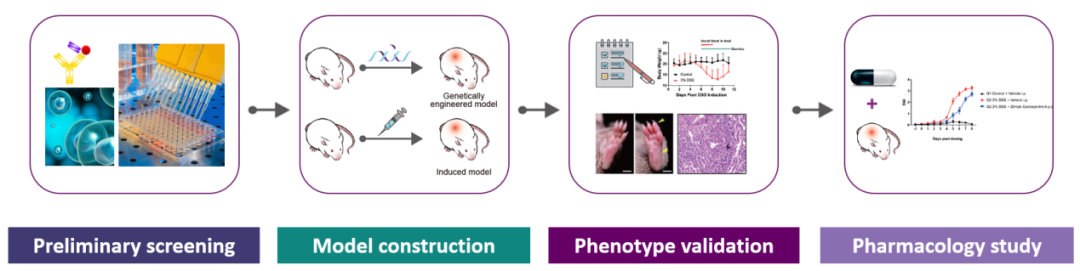
(2)AD疾病小鼠模型资源

参考资料
1.Weidinger, S. and N. Novak, Atopic dermatitis. The Lancet, 2016. 387(10023): p. 1109-1122.
2. Garmhausen, D., et al., Characterization of different courses of atopic dermatitis in adolescent and adult patients. Allergy, 2013. 68(4): p. 498-506.
3.Laughter, M.R., et al., The global burden of atopic dermatitis: lessons from the Global Burden of Disease Study 1990–2017*.British Journal of Dermatology, 2021. 184(2): p. 304-309.
4.Ständer, S., Atopic Dermatitis. The New England journal of medicine. 384(12): p. 1136-1143.
5.Sroka-Tomaszewska, J. and M. Trzeciak, Molecular Mechanisms of Atopic Dermatitis Pathogenesis. International Journal of Molecular Sciences, 2021. 22(8): p. 4130.
6.Cork, M.J., et al., Epidermal Barrier Dysfunction in Atopic Dermatitis. Journal of Investigative Dermatology, 2009. 129(8): p. 1892-1908.
7.Nutten, S., Atopic dermatitis: global epidemiology and risk factors. Annals of nutrition & metabolism. 66 Suppl 1: p. 8-16.
8.Cork, M.J., S.G. Danby, and G.S. Ogg, Atopic dermatitis epidemiology and unmet need in the United Kingdom. The Journal of dermatological treatment. 31(8): p. 801-809.
9. Simon, D. and T. Bieber, Systemic therapy for atopic dermatitis. Allergy. 69(1): p. 46-55.
10. Hijnen, D.J., et al., Efficacy and safety of long-term treatment with cyclosporin A for atopic dermatitis. J Eur Acad Dermatol Venereol, 2007. 21(1): p. 85-9.
11.Bieber, T., Atopic dermatitis: an expanding therapeutic pipeline for a complex dis ease. Nature reviews. Drug discovery.21(1): p. 21-40.
12.Brunner, P.M., E. Guttman-Yassky, and D.Y.M. Leung, The immunology of atopic dermatitis and its reversibility with broad-s pectrum and targeted therapies. The Journal of allergy and clinical immunology. 139(4S): p. S65-S76.