7月28日是已故诺贝尔奖得主巴鲁克·布隆伯格的诞辰日,为纪念这位乙肝病毒发现者,WHO自2011年开始将每年的7月28日定为世界肝炎日。今年是第十二个世界肝炎日,全球主题为“Bringing hepatitis care closer to you”。

肝脏是人体的重要器官,具有代谢、排毒、造血和免疫功能,负责人体90%的营养运输和排毒解毒,对人体健康的意义非常之大。但其也容易受到体内外的刺激从而产生病变,如酗酒、肥胖、饮食、药物、病毒等可能引发酒精肝、脂肪肝、药物肝和肝炎等肝病,如果不进行及时干预和治疗,最终将可能发展为肝硬化和肝癌等。
肝病的种类按照发病机理一般可以分为病毒性肝炎、代谢相关性脂肪肝病、酒精性肝损伤、药物性肝损伤和自身免疫性肝炎等5大类,其中病毒性肝炎是常见的也是危害大的一类肝病。
肝病的主要种类分析

据相关统计,中国是全球肝病负担最重的国家,拥有乙肝病毒(HBV)携带者9000万人,丙肝病毒(HCV)携带者1000万人,非酒精性肝病患者1.7-3.1亿人,肝硬化患者700万人。庞大的基础肝病患者造成我国每年新增肝癌患者高达46万人。
我国主要肝脏疾病患者数量
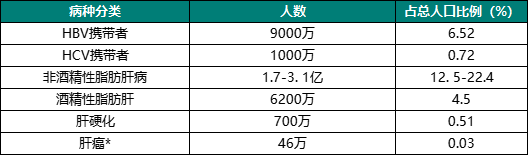
注:*表示每年新增患者(数据来源于Jia Xiao et al.,Journal of Hepatology.2019)
除了大部分丙肝患者可以治愈以外,其他肝病患者均难以治愈,亟需临床特效药物。
众所周知,肝病研究、肝病治疗药物开发离不开临床前的动物模型实验。今天就借此机会,给大家简单介绍一下在肝病的研究和治疗中起到重要作用的小鼠模型。
非酒精性脂肪肝炎(NASH)模型
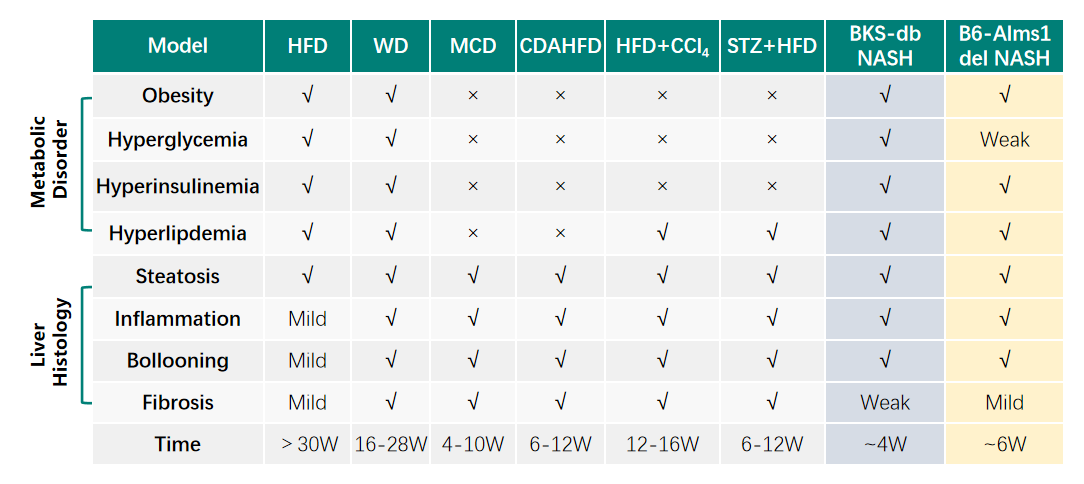
目前常用的NASH模型有三类:高脂饮食诱导的NASH模型、营养素缺乏饮食诱导的NASH模型、化学毒素诱导的NASH模型。但是,传统造模方式有周期长、代谢紊乱表型弱等不足。而基因编辑小鼠在药效实验中表型较传统诱导模型更为稳定,并能通过高脂饮食诱导在较短时间获得相对理想的NASH药物评价模型,为药物研发进度争取宝贵的时间
集萃药康基于基因编辑小鼠构建了两种NASH模型:BKS-db NASH和B6-Alms1 del NASH。其具有肥胖、高血糖症、高血脂症和胰岛素抵抗等代谢紊乱特征,并且随着周龄增加,可以观察到脂肪肝表型。这两种模型均可以在西方饮食饲料(WD)加速其代谢紊乱和肝脏损伤进程,大大缩短了造模周期,能够更好地用于药物评价。相较BKS-db NASH模型,B6-Alms1-del NASH模型还具备中度肝脏纤维化的特点,可用于评估抗NASH药物对肝脏纤维化的治疗效果。
NASH模型及其表型特点
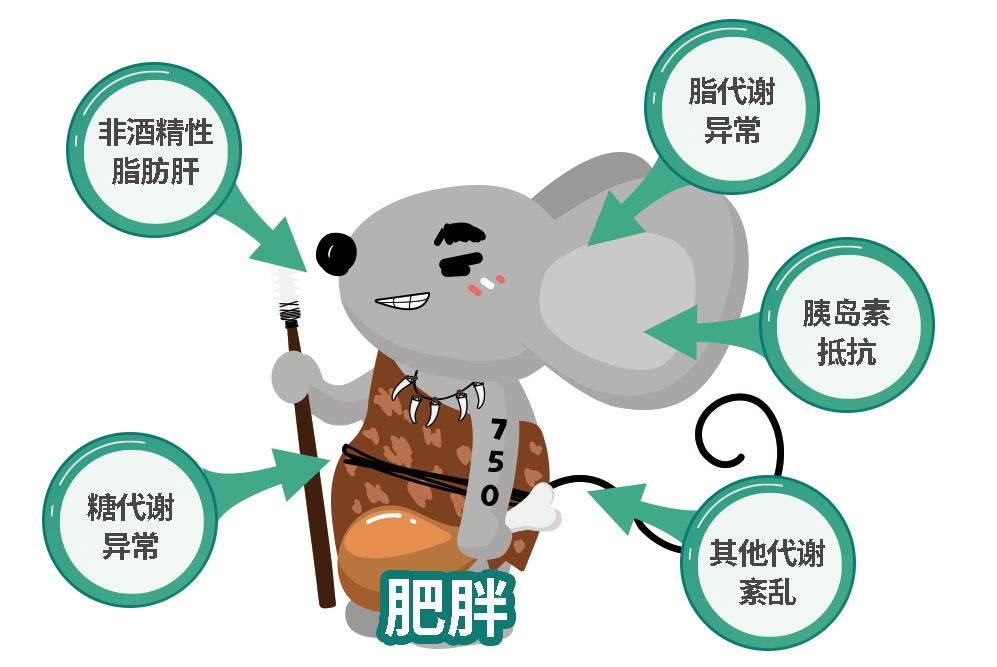
除此之外,集萃药康新开发的一款产品-野生鼠750(全称∶B6-Chr1YP1,品系编号:D000750),也可满足NASH评价需求。该小鼠是在C57BL/6J基础上引入了野生小鼠1号染色体从而获得的新模型,其在8周龄后自发肥胖,并且糖脂代谢出现紊乱。在大周龄小鼠中,可观察到明显的脂肪肝表型,WD诱导可进一步加速NASH病症出现,包括脂肪变性、小叶炎症等,同时表现出中等程度纤维化。
肝损伤模型
常见的肝损伤模型主要有:外源性诱导肝损伤模型和内源性肝损伤模型
外源性诱导肝损伤:主要是指通过化学性肝毒物质,如四氯化碳(CCL4)、丙烯醇、D一氨基半乳糖、呋喃等化学物质造成肝损伤。但是外源性的再生刺激对宿主细胞同样有增殖作用,不能产生持续的肝损伤。
内源性肝损伤:主要是指基于基因编辑造成肝损伤,也就是在动物体内通过表达毒性产物持续发生肝损伤。主要有三种模型:
1、uPA模型:该模型是在小鼠肝脏中特异性表达尿激酶型纤溶酶原激活物(Urokinase plasminogen activator,uPA),导致小鼠凝血时间增长,血浆尿激酶型血浆素原激活剂活度增高,造成肝脏损伤。
2、Fah-/-基因敲除动物模型:当Fah(延胡索酰乙酰乙酸水解酶)基因发生缺失或突变时,会产生有毒的延胡索酰乙酰乙酸盐和马来酰乙酰乙酸,并产生其次级代谢产物丙酮,对肝、肾造成损伤。
3、表达HSV-Tk/GCV自杀基因系统模型:在动物模型中引入I型单纯疱疹病毒(herpes simplex virus-type I, HSV-I)胸腺嘧啶激酶(thymidine kinase, Tk),当外源添加药物更昔洛韦(Gancyclovir, GCV)时,胸苷激酶将无毒的药物前体GCV磷酸化为强毒性代谢物三磷酸丙氧鸟苷,其作为DNA和RNA链的终止剂,将小鼠自身的肝脏细胞杀死。
集萃药康在重度免疫缺陷NCG小鼠上,制作了肝脏特异性表达HSV-Tk自杀基因系统的可诱导肝损伤模型 Inducible liver injury-NCG。该模型在未给予诱导药物GCV时,不会出现肝损伤,只有给与诱导药物处理,才会出现肝损伤。
肝脏人源化模型
肝脏人源化小鼠是通过基因编辑手段,特异清除小鼠肝脏细胞,将人肝脏细胞植入小鼠体内,形成的拥有人类肝脏细胞的小鼠,可实现人肝炎病毒,如HBV、HCV的感染和复制的过程。此外,嵌合了人肝细胞的肝脏人源化小鼠,可表达人特异性代谢酶,在药物临床前代谢研究中,能更真实的反映药物在人体内的代谢途径,提高药物临床前PK/PD准确性,降低了药物进行人体实验的安全风险。
基于此,集萃药康开发了肝脏人源化小鼠模型hHeps-NCG。该模型在Inducible liver injury-NCG上诱导小鼠肝细胞损伤,接受人肝细胞移植3周后,即可在血清中检测到人白蛋白(hALB)的表达,且白蛋白水平随周龄增加而升高,9周后人源肝脏重建率可达60%+,并且在人源化小鼠的肝脏可检测到人肝特异性代谢酶的表达。

hHeps-NCG小鼠移植人肝细胞后的白蛋白表达检测

hHeps-NCG小鼠肝脏人特性代谢酶检测
该模型的创制为肝脏疾病的病理、疫苗和新药研发以及人肝细胞代谢功能等方面的体内研究提供了可靠的工具。