浙大孙毅教授团队揭示UBE2M-RBX1拟素化-CRLs对维持Treg细胞的功能至关重要(含部分动物实验小鼠数据)
2022年5月31日,浙江大学孙毅教授团队在Nature Communications(IF=17)在线发表了题为“The Ube2m-Rbx1 neddylation-Cullin-RING-Ligase proteins are essential for the maintenance of Regulatory T cell fitness”的论文。该研究使用来自集萃药康的多种小鼠模型Rbx1fl/fl、Ube2mfl/fl、B6/JGpt-Bcl2l11em1Cflox/Gpt(Bim fl/fl)、B6/JGpt-Rag1em1Cd/Gpt进行研究,结合流式细胞分选、转录组学与蛋白质组学分析等多个技术手段,揭示了UBE2M-RBX1拟素化-CRLs维持Treg细胞的功能特性。

泛素-蛋白酶体系统功能研究相关:
泛素-蛋白酶体系统作为维持体内蛋白质稳态的重要机制,其功能的正常发挥通常需要3种泛素酶的协同作用:E1泛素激活酶、E2泛素结合酶及E3泛素连接酶。其中,E3泛素连接酶发挥着决定底物特异性的作用。Cullin-RING连接酶(CRLs)作为最大的E3泛素连接酶家族,由Cullin、Adaptor、Receptor以及两个催化亚基(RBX1/ROC1和RBX2/SAG)组成[1],参与催化体内约20%的蛋白质泛素化[2]。蛋白质拟素化(Neddylation)是与泛素化类似的一种类泛素化修饰,其介导的CRLs的激活是特异性免疫调节蛋白降解所必需的[3-5]。调节性T细胞(Treg细胞)发挥抑制免疫细胞过度活化,维持机体免疫稳态的作用[6]。尽管拟素化修饰/CRLs和Treg细胞都在免疫调节中发挥着重要的作用。但截至目前,尚未有研究使用条件敲除小鼠模型来阐明CRLs(通过RBX1/RBX2)和拟素化修饰(通过UBE2M/UBE2F)在调节Treg细胞功能和存活以维持免疫系统稳态方面的生理作用。

RBX1在Treg细胞中通过依赖UBE2M和独立的机制发挥作用
1、Treg细胞中Rbx1缺失导致早发致死性炎症紊乱而Sag缺失小鼠无明显炎症
为了研究CRLs在体内调节Treg细胞中的作用,研究者使用Foxp3YFP-cre (Foxp3cre)工具鼠与Flox小鼠配繁,获得了分别在Treg细胞中特异性敲除Rbx1(Foxp3cre;Rbx1fl/fl)和Rbx2/Sag(Foxp3cre;Sagfl/fl )的小鼠。Treg中Rbx1的缺失导致小鼠出现早发致死性炎症紊乱,表现为出生后37天致死率达100%,多种类型的免疫细胞及细胞因子均被显著激活。而Treg中Sag缺失的小鼠健康可育,无明显炎症反应。表明RBX1和SAG在调节Treg细胞的功能上具有相对独立性。
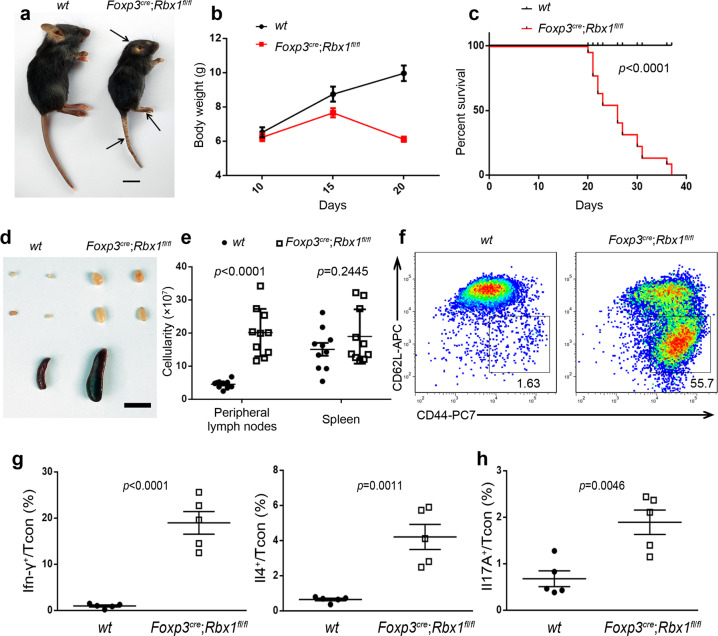
图1.Treg细胞中Rbx1缺失导致早发致死性炎症紊乱
2、Rbx1缺失导致Treg细胞抑制功能受损
为了研究Rbx1缺失是否损害Treg细胞的抑制功能,研究者将等量的wt或Rbx1缺陷小鼠Treg细胞与初始CD4+ T细胞一起注射到免疫缺陷Rag1−/−小鼠中进行体内抑制试验。结果显示,注射Rbx1缺陷Treg细胞的小鼠发生了严重的结肠炎。进一步研究发现,出生8天的Foxp3cre;Rbx1fl/fl幼鼠体内,Treg细胞比例正常,但表现为免疫系统过度激活,并且注射wt Treg细胞,仍不能挽救致命性的炎症。这些结果表明,RBX1对Treg细胞的免疫抑制功能是必不可少的。
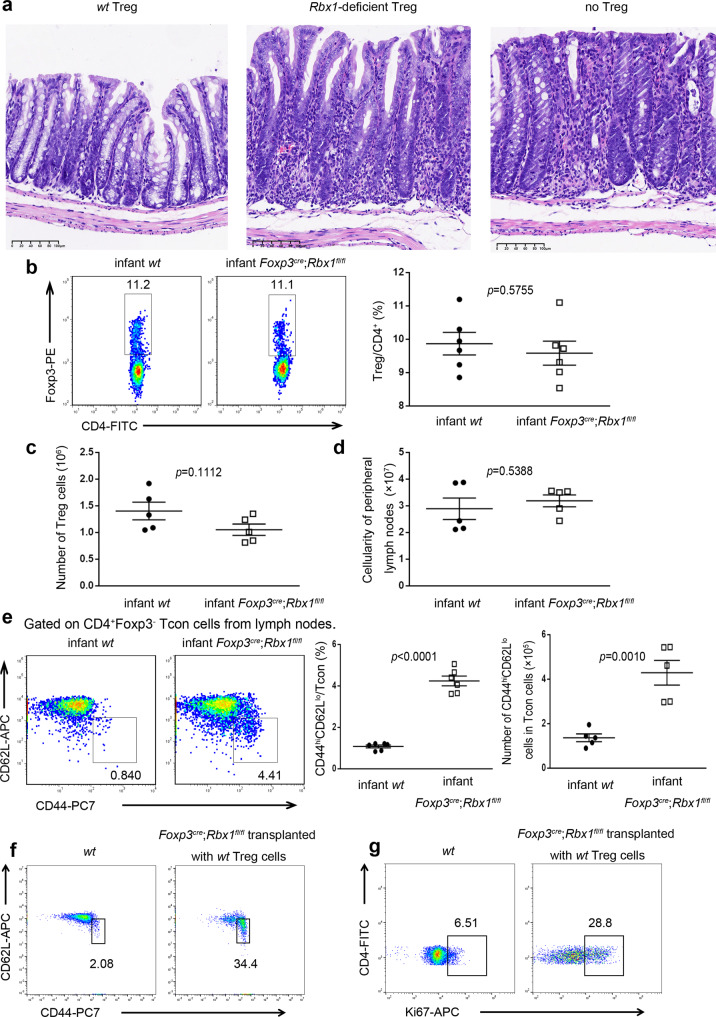
图2.Rbx1缺陷Treg细胞抑制功能受损
3、Rbx1缺失导致Treg细胞中静稳亚群无法向效应亚群分化
为了进一步探究Rbx1缺失对Treg细胞分化的影响。研究者对wt和Rbx1缺失的Treg细胞进行单细胞转录组学数据分析,并分成10余个亚群。经过分析,发现Rbx1缺失导致0号亚群(表达了高水平的初始Treg细胞特征基因)的比例增加,3和4号亚群(高表达多种Treg细胞功能分子)的比例减少。KEGG通路富集分析显示,3和4号亚群中T细胞受体和其他Treg相关通路被激活,是效应性Treg细胞亚群。这些结果表明,Rbx1缺失导致Treg细胞中静稳亚群无法向效应亚群分化。

图3.Rbx1缺陷Treg细胞的单细胞转录组学
4、寻找RBX1介导泛素化的直接底物
RBX1是E3泛素连接酶的催化亚基,能够催化底物蛋白的泛素化,促进蛋白降解。为了确定Treg细胞中RBX1可能的直接底物,研究者直接比较蛋白质组学和转录组学数据。并推测在Rbx1缺失的Treg细胞中候选底物应该呈现蛋白质丰度升高,而mRNA水平基本不变的情况。由此,研究者共找到了57个候选底物。
5、Bim的敲除可以部分挽救Foxp3cre;Rbx1fl/fl小鼠的炎症表型
在57个候选底物中,BIM蛋白已被证实可被RBX1泛素化并降解,且BIM是一种促凋亡蛋白并参与Treg细胞的调控。因此,推测BIM的积累可能部分介导了Rbx1缺陷Treg细胞的某些表型。研究者进一步构建了Treg细胞中同时敲除Rbx1和Bim的小鼠(Foxp3cre;Rbx1fl/fl;Bimfl/fl)进行表型挽救实验。结果发现,与Foxp3cre;Rbx1fl/fl相比,Bim的缺失减弱了其严重的炎症表型,但仍未能改善其生存率。表明BIM部分参与了RBX1在Treg细胞中的功能。
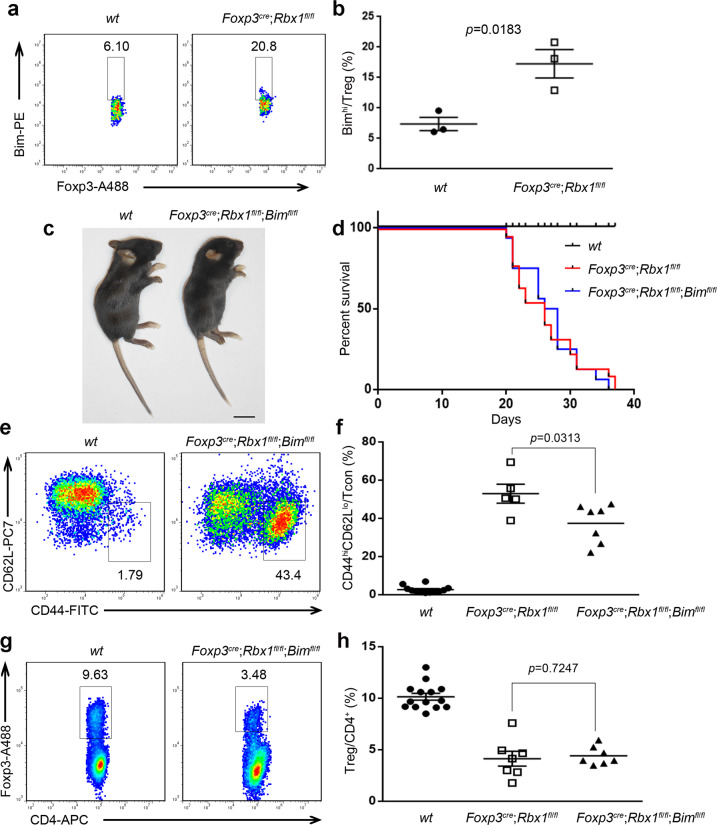
图4.Bim缺失对Foxp3cre;Rbx1fl/fl小鼠表型的影响
6、Treg细胞中Ube2m缺失小鼠的炎症紊乱相对较弱
已有研究表明,CRLs的E3连接酶活性需要Cullin的拟素化。由于UBE2M与RBX1 E3偶联促进Cullins1-4的拟泛素化,而UBE2F与RBX2/SAG E3偶联促进Cullin 5拟泛素化。为了探究RBX1在Treg细胞中的关键作用是否依赖于UBE2M,以及UBE2F是否对Treg细胞来说是非必要的。研究者分别构建了Treg细胞中特异性敲除Ube2m(Foxp3cre;Ube2mfl/fl)和Ube2f(Foxp3cre;Ube2f fl/fl)的小鼠。与Treg细胞中RBX2/SAG缺失的小鼠相同,Ube2f缺失的小鼠也无明显的炎症反应,表明在稳定状态下,UBE2F-RBX2-CRL5轴对Treg细胞的功能和存活并不重要。与Treg细胞中Rbx1缺失的小鼠相比,Ube2m缺失的小鼠也观察到类似但较轻的表型。
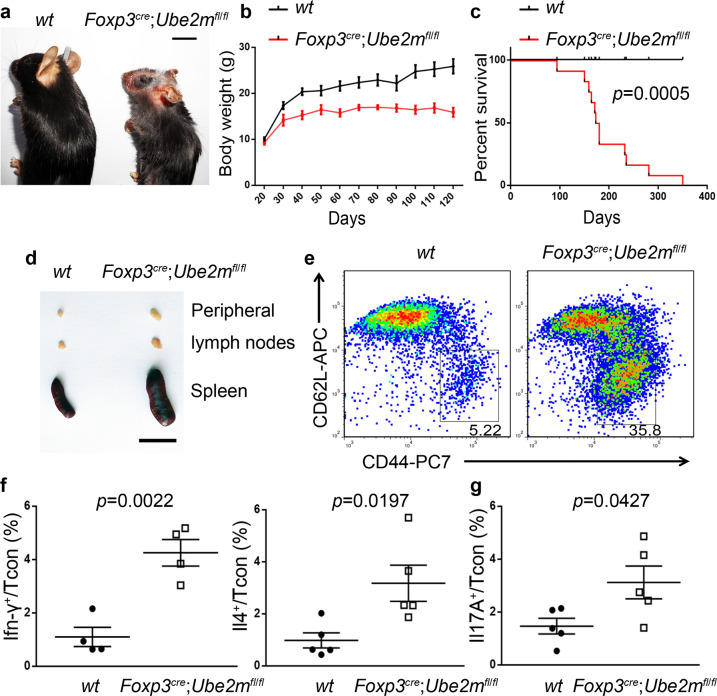
图5.Foxp3cre;Ube2mfl/fl小鼠炎症紊乱相对较弱
7、Treg细胞中RBX1和UBE2M调控的信号通路分析
Foxp3cre;Rbx1fl/fl和Foxp3cre;Ube2mfl/fl小鼠之间的表型差异提示了RBX1和UBE2M在维持Treg细胞功能方面存在差异。研究者进一步对Rbx1缺陷和Ubem2缺陷的Treg细胞之间的转录组数据进行分析,无偏聚类分析显示了良好的整体校正,且两组数据在几组基因和通路中确实存在独特的差异,表明CRLs和拟素化在调节Treg细胞功能方面确实既有相同的机制,也有各自独立的通路。
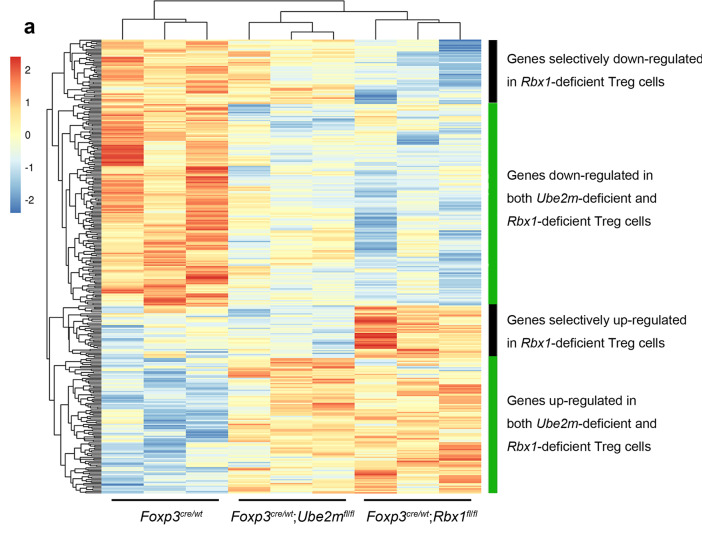
图6.Rbx1和Ube2m缺失的Treg细胞中四类基因的差异表达
结论
UBE2M-RBX1轴对维持Treg细胞功能是必须的,而RBX1的调节功能并不完全依赖于UBE2M,表明CRLs的拟素化激活具有更复杂的调控机制。
参考文献
1. Zhao, Y. & Sun, Y. Cullin-RING ligases as attractive anti-cancer targets. Curr.Pharm. Des. 19, 3215–3225 (2013).
2. Soucy, T. A. et al. An inhibitor of NEDD8-activating enzyme as a new approach to treat cancer. Nature 458, 732–736 (2009).
3. Braun, T. et al. Targeting NF-kappaB in hematologic malignancies. Cell Death Differ. 13, 748–758 (2006).
4. Lee, J. H., Elly, C., Park, Y. & Liu, Y. C. E3 Ubiquitin ligase VHL regulates Hypoxia-Inducible Factor-1α to maintain regulatory T cell stability and suppressive capacity. Immunity 42, 1062–1074 (2015).
5. Palmer, D. C. & Restifo, N. P. Suppressors of cytokine signaling (SOCS) in T cell differentiation, maturation, and function. Trends Immunol. 30, 592–602 (2009).
6. Kim, J. M., Rasmussen, J.P. & Rudensky, A.Y. Regulatory T cells prevent catastrophic autoimmunity throughout the life span of mice. Nat. Immunol. 8, 191-197 (2007).