胰腺癌是一种恶性度很高的消化系统肿瘤,是预后最差的恶性肿瘤之一,因此也被称为“癌症之王”。据统计,全球范围内胰腺癌(PancreaticCancer)的发病率呈逐年上升趋势。胰腺癌早期隐匿,确诊时大多已到晚期,因此仅15%的患者符合手术治疗。目前,胰腺癌仍缺乏治疗有效的治疗方法,尽管传统化疗和放疗已进行了改进,辅助治疗也已应用于临床,但胰腺癌患者的5年生存率仍低于9%,靶向治疗、免疫治疗等新的治疗方法仍有待研究。
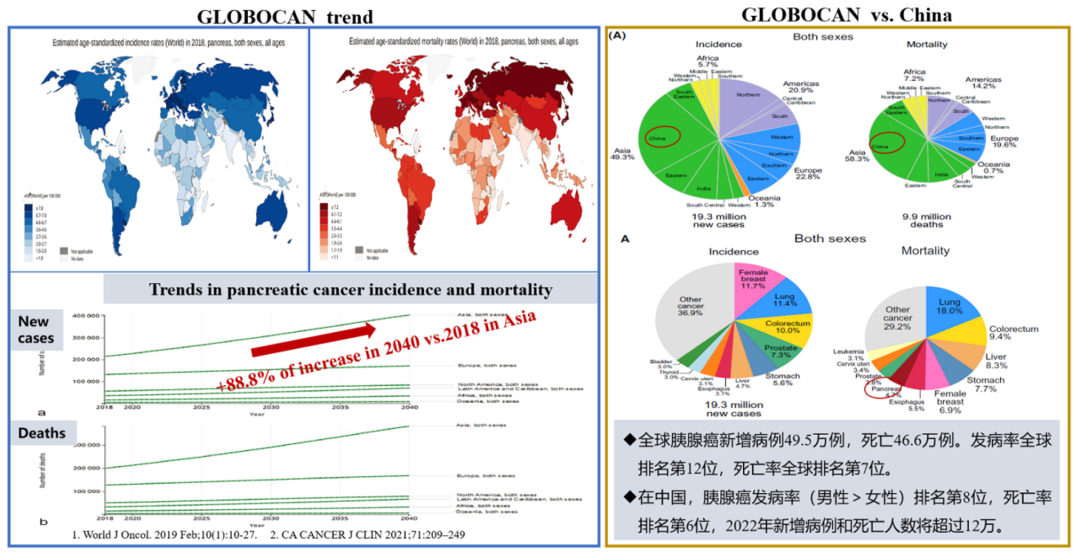
图1:胰腺癌流行病学(图片来源于网络)
小鼠胰腺癌动物模型的建立
通过构建动物模型,在动物体内模拟胰腺癌发生发展过程,探索肿瘤发生的分子机制,是研究癌症治疗方法必不可少的过程。但单一的动物模型对肿瘤的模拟程度有限,在实际研究中还需结合具体需求选择合适的动物模型,才能更好地达到研究目的。下面小编就带大家一起了解一下胰腺癌小鼠模型有哪些。
供应胰腺癌小鼠模型种类
主流的胰腺癌小鼠模型主要分为三类:致癌物诱导模型、基因修饰自发肿瘤模型和移植瘤模型。
1.致癌物诱导动物小鼠模型
一般通过饲喂、皮下/静脉/胰腺原位注射等途径,使N-亚硝酸双(2-氧丙基)-胺(BOP)等致癌物作用于动物胰腺组织,通过改变环境因素来模拟胰腺癌发生发展的全过程,可诱导形成胰腺癌小鼠模型。诱导模型能在较短时间内表现出与人胰腺癌发生、发展类似的过程,但致癌剂特异性较差,除胰腺癌外,也会引起肝癌等其他肿瘤的产生,且实验动物死亡率较高。
2.自发肿瘤动物小鼠模型
利用基因工程技术,使肿瘤发生发展相关基因的过表达、缺失或突变,从而导致小鼠发生肿瘤,通过这种方法可建立自发胰腺癌模型。据统计,约90%的胰腺导管腺癌(PDAC)患者携带Kras基因突变,70%的PDAC患者携带Trp53基因突变,研究表明,携带Kras和Trp53共突变的小鼠可发展为胰腺癌。通过基因编辑技术使基因发生突变继而建立自发肿瘤模型,此模型操作简单且效率更高。同时这种自发胰腺癌细胞系成瘤后能更好的表现胰腺导管腺癌的特性,可用于PDAC的研究与药物研发。
3.移植瘤动物小鼠模型
将人或小鼠原发的胰腺癌组织或细胞移植到小鼠身上,使其生长成肿瘤的动物模型,这种方法可以建立异种移植或同种移植的移植瘤模型。同种移植一般采用鼠源组织或细胞,除了选择PAN02等常用的鼠源胰腺癌细胞系,也可以通过自发胰腺癌的肿瘤组织分离传代获得的mPAkpc胰腺癌细胞系,用于移植瘤模型。移植瘤动物模型易于建立,但肿瘤在免疫缺陷动物体内的生长方式与人体有较大差异。
不同胰腺癌动物模型的比较和应用选择方法表格:

KPC模型—具有胰腺癌发生发展特征和肿瘤环境
通过B6-KrasLSL-G12D、B6-p53R172H和B6-Pdx1-iCre三种基因工程小鼠配繁获得的阳性小鼠,即KPC小鼠,是目前应用最广泛的胰腺癌自发肿瘤模型之一。KPC小鼠从出生后表现为慢性持续进展的癌前病变,部分动物可以进展为侵袭性和转移性癌,很好地模拟了人胰腺上皮内瘤变(PanINs)逐渐进展为PDAC的病理过程。
集萃药康采用基因编辑技术构建了KPC自发肿瘤相关小鼠模型,可用于胰腺癌发生的机制和治疗方法的研究,助力临床前PDAC免疫反应研究及新型免疫治疗药物测试。
KPC小鼠模型在胰腺导管癌验证数据
B6-KPC致癌进程:小鼠在10周龄可发展为胰腺癌,12周龄可发展为侵袭性胰腺导管腺癌。

图2:B6-KPC小鼠胰腺、肝脏、肺组织H&E染色
结果显示:与wildtype小鼠相比,B6-KPC小鼠在10周龄时发展为胰腺导管癌,癌细胞呈腺样排列,肝脏和肺内出现炎性病灶;12周龄时,B6-KPC小鼠胰腺上皮内瘤变并发胰腺导管癌,上皮病变具有乳头状结构,并可见由透明细胞构成的管状结构发展为胰腺导管癌,同时出现肺转移并可见炎性细胞浸润。
除提供胰腺癌自发肿瘤模型外,集萃药康同时布局了基于自发肿瘤的细胞系分离建系及皮下、原位或转移瘤模型构建服务,并开展相应的体内药效验证。
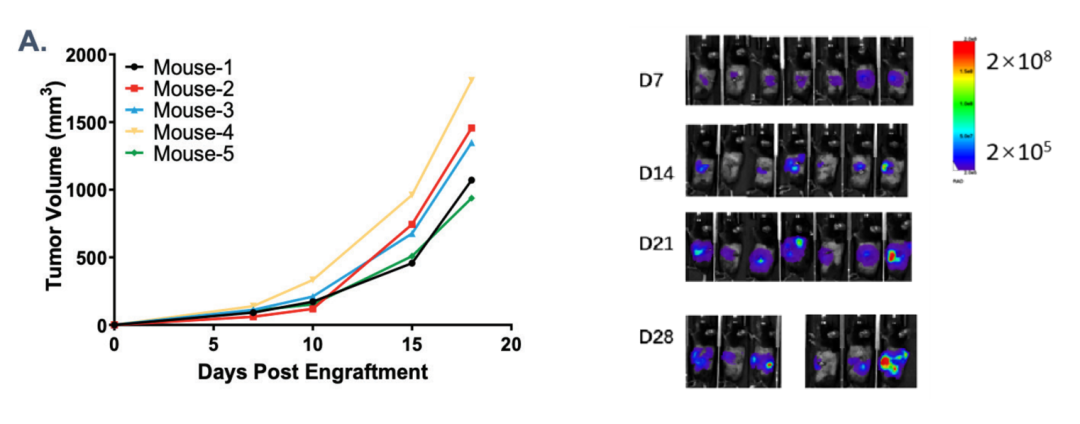
图3:mPAKPC细胞系皮下接种成瘤(左)及原位接种成瘤(右)
结果显示:由B6-KPC胰腺肿瘤组织获得的细胞系原位胰腺接种成瘤或皮下瘤块接种成瘤,均可形成稳定生长的胰腺肿瘤。
药效验证数据

图4:mPAKPC皮下成瘤药效评价
药效试验证明:mPAKPC细胞系皮下瘤后,分析肿瘤组织对免疫治疗药物的响应情况,结果提示皮下成瘤后对吉西他滨联用CD40激动剂有较好地响应,联合治疗效果更好。

图5:mPAKPC原位成瘤药效分析
结果显示:B6-hPD1/hCTLA4小鼠原位mPAKPC细胞系成瘤后,分析肿瘤组织对免疫检查点抑制剂的响应情况,结果提示对PD1靶点抑制剂有较好地响应。
集萃药康胰腺癌相关品系推介
品系编号 | 品系简称 | 品系名称 |
T015832 | B6-KPC | B6/JGpt-Trp53em1Cin(LSL-R172H)Krasem1Cin(loxP-SA-stop-SD-loxP-G12D)Pdx1em1Cin(P2A-iCre)/Gpt |
B6/JGpt-Trp53em1Cin(LSL-R172H)/Gpt | ||
B6/JGpt-Krasem1Cin(loxP-SA-stop-SD-loxP-G12D)/Gpt | ||
B6/JGpt-Trp53em1Cin(LSL-R172H)Krasem1Cin(loxP-SA-stop-SD-loxP-G12D)/Gpt | ||
B6/JGpt-Pdx1em1Cin(P2A-iCre)/Gp |
参考文献
【1】郑荔文,刘长安.胰腺癌免疫治疗研究进展[J].临床医学进展,2022, 12(2): 1169-1177
【2】SavitaBisht , GeorgFeldmann.Animal models for modeling pancreatic cancer and noveldrug discovery[J]Expert Opin Drug Discov. 2019Feb;14(2):127-142.
【3】QShi , KXie.Experimental animal models of pancreatic cancer(review)[J].Int J Oncol. 2000 Aug;17(2):217-25.
【4】LCharles Murtaugh.Pathogenesis of pancreatic cancer: lessons fromanimal models[J].Toxicol Pathol. 2014 Jan;42(1):217-28.
【5】程东峰,叶靳华等.胰腺癌动物模型的研究进展[J].国际外科学杂志,2011,38(3):173-175.