糖尿病是一种慢性病,当胰脏不能产生足够的胰岛素或者当身体不能有效利用产生的胰岛素时,就会出现糖尿病。据统计,2021年全球约5.37亿成年人(20-79岁)患有糖尿病;预计到2030年,该数字将上升到6.43亿;到2045年将上升到7.83亿。其中,2011-2021年,我国糖尿病患者数量从9000万增至1.4亿[1]。糖尿病已经成为威胁人类生命健康的主要危害之一。
随着分子靶点研究的日益加深,小分子药物作为靶向治疗的有力工具,越来越受到药物研发人员的重视。近年来,胰高血糖素样肽1受体 (GLP-1R) 已经成为糖尿病研究的热门靶点之一。
胰高血糖素样肽1受体 (GLP-1R)简介
GLP-1R属于G蛋白偶联受体B簇中胰高血糖素受体亚家族,广泛分布在胰腺、大脑、小肠、心脏、肺等组织中[2],当其被GLP-1或人工合成的GLP-1R激动剂激活后发挥生理功能,如刺激胰岛素的分泌,并抑制胰高血糖素的分泌,从而促进葡萄糖的新陈代谢。同时,它还能起到延缓胃排空和抑制食欲的效果[3,4]。因此靶向GLP-1R开发降糖、减重药物的热潮不断。
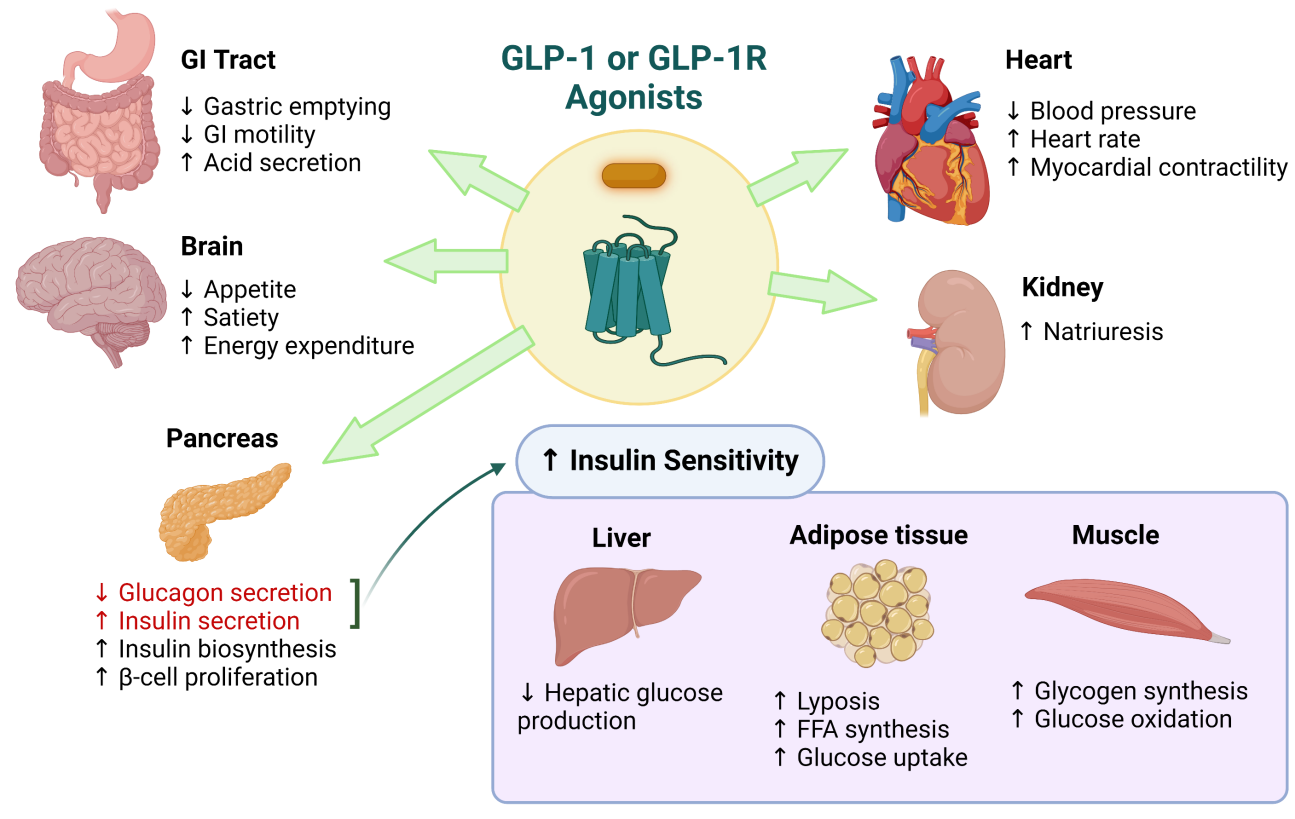
图1:GLP-1/GLP-1R在不同组织器官对应的生理功能
(图源:https://bpsbioscience.com/glp-1r-diabetes)
靶向GLP-1R降糖药市场研究情况
在降糖市场,已有多款靶向GLP-1R降糖药获得美国食品药品管理局(FDA)批准上市,是全球市场上除胰岛素外市场规模最高的降糖药,市场集中度持续提升。
表1 FDA获批的靶向GLP-1R降糖药(来源:医药魔方)
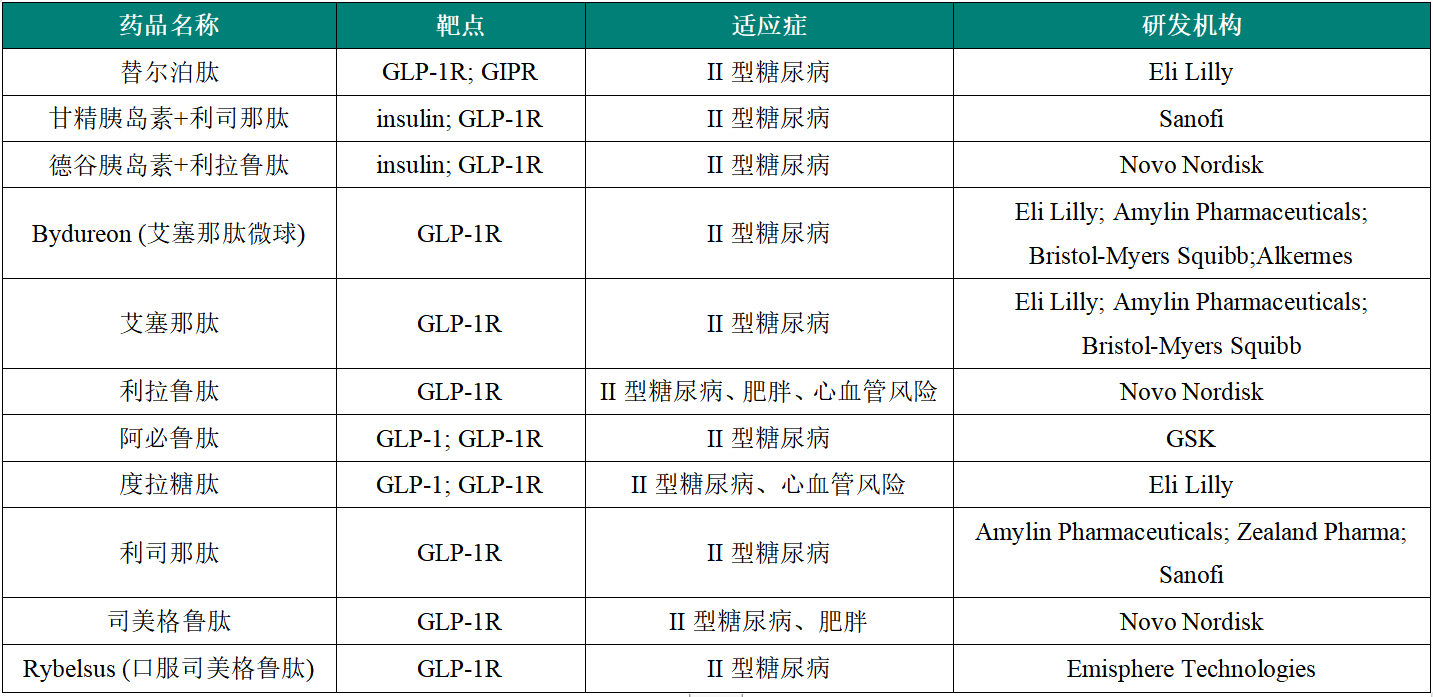
GLP-1R激动剂正在引领全球降糖药的时代变革,随着GLP-1参与各种疾病的病理机制逐渐清晰,GLP-1R激动剂的适应症也将逐渐拓展到肾病、心血管疾病、NASH等更广泛的疾病领域。
GLP-1R人源化小鼠:糖尿病/肥胖药物筛选研究工具
集萃药康多年来深耕模式动物领域,现已成功开发GLP-1R人源化小鼠模型(NO. T053832),该模型原位插入人源GLP-1R编码区和3’UTR区,为糖尿病/肥胖药物筛选,相关药效实验等研究提供了强有力的工具。
1、GLP-1R模式动物模型验证数据:
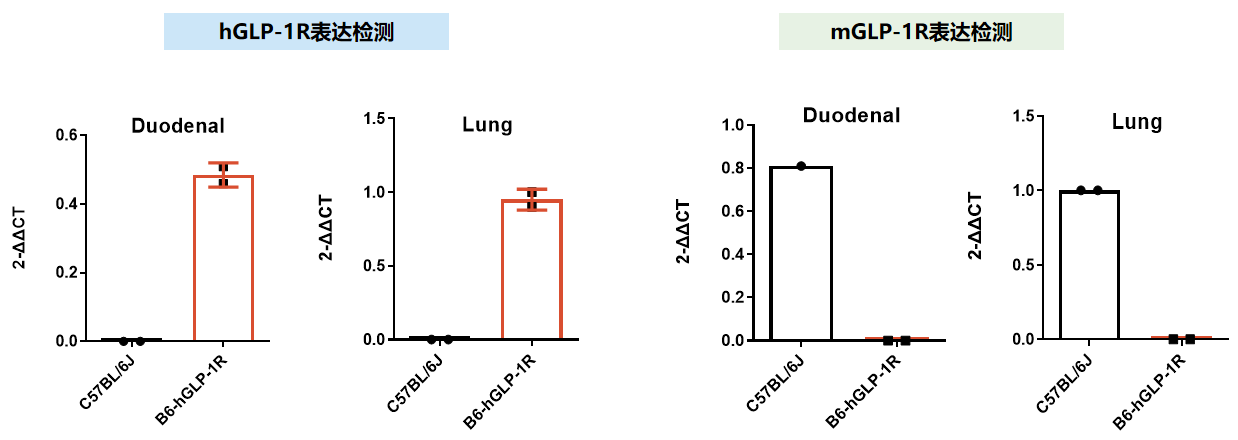
图2:B6-hGLP-1R小鼠mRNA表达检测
结果显示:B6-hGLP-1R小鼠十二指肠和肺组织高表达人源GLP-1R mRNA,不表达鼠源GLP-1R mRNA。
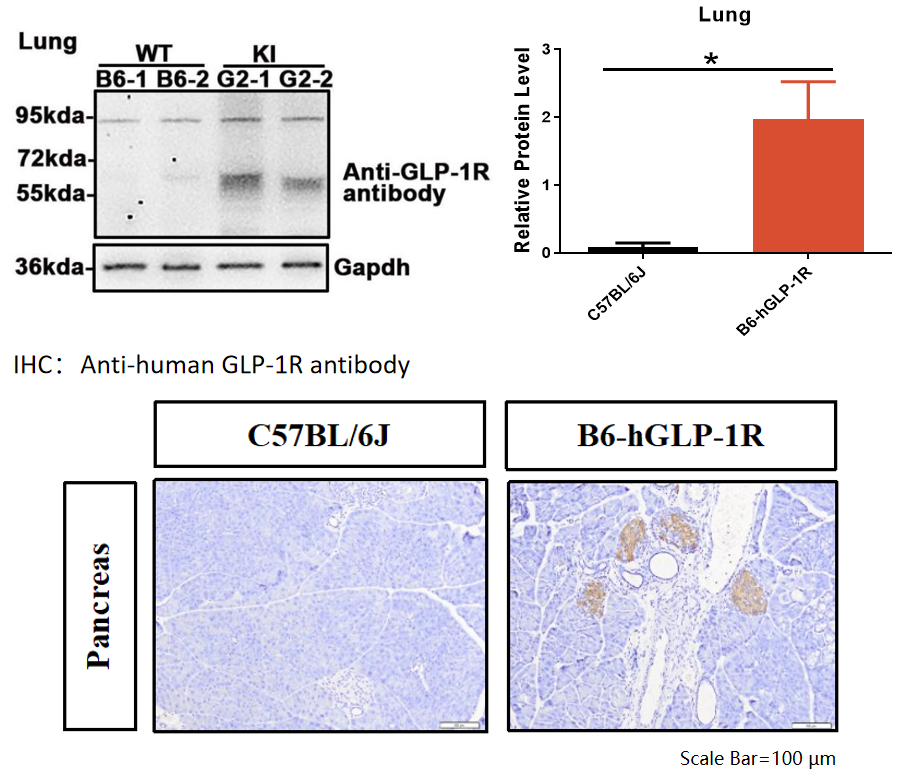
图3:B6-hGLP-1R小鼠蛋白表达检测
结果显示:B6-hGLP-1R小鼠肺和胰腺组织高表达人源GLP-1R蛋白。
2、GLP-1R激动剂降糖药效验证数据:
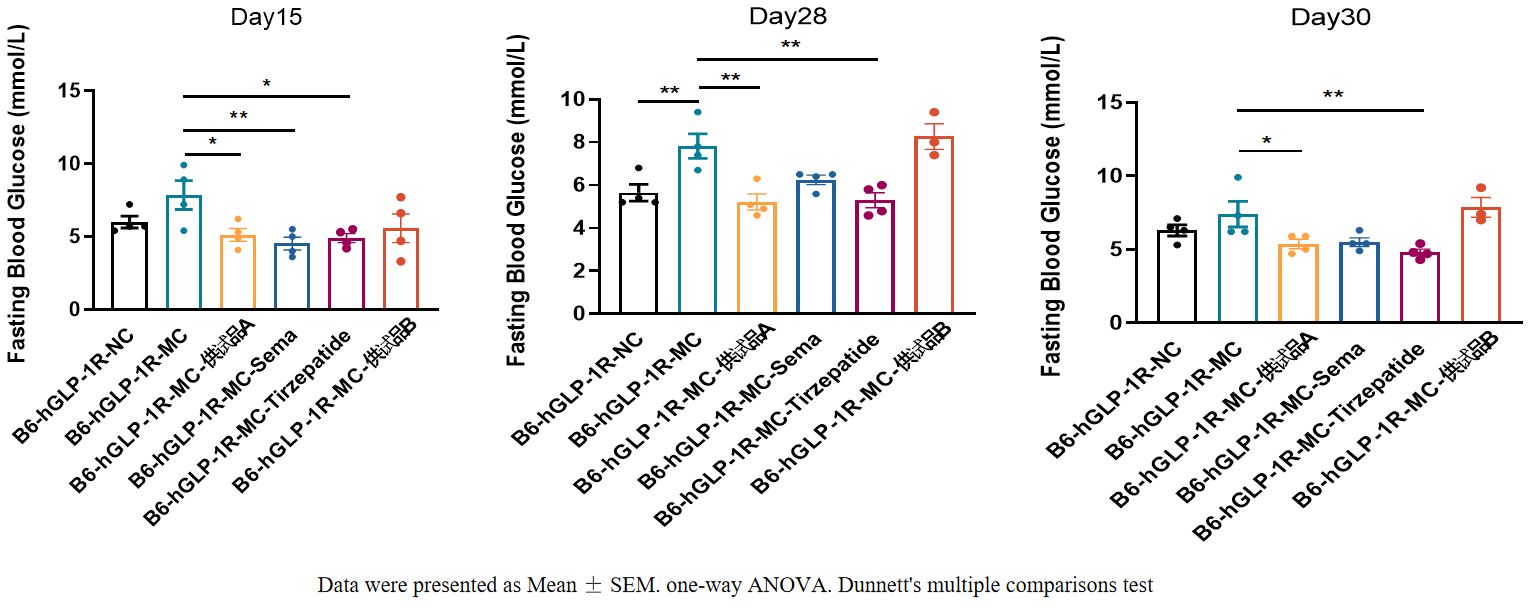
图4:血糖检测实验(合作验证数据)

图5:IPGTT实验(合作验证数据)
与正常饲料喂养的B6-hGLP-1R小鼠(NC),高脂饲料喂养B6-hGLP-1R小鼠(MC)血糖升高、糖耐量受损;针对造模的GLP-1R人源化小鼠,阳性药及供试品A均表现出很好的降血糖效果,证明GLP-1R人源化小鼠是进行糖尿病药物筛选的良好模型。
参考文献:
1. 国际糖尿病联盟 (IDF). 全球糖尿病地图(第10版). 2021
2. Mohd MA, Koole C, et al. Molecular mechanisms underlying physiological and receptor pleiotropic effects mediated by GLP-1R activation. British Journal of Pharmacology, 2014, 171 : 1114–1128. DOI: 10.1111/bph.12313
3. Brubaker PL, Drucker DJ. Structure-function of the glucagon receptor family of G protein-coupled receptors: the glucagon, GIP, GLP-1, and GLP-2 receptors. Receptors & Channels, 2011, 8 : 179–188.
4. Francisco Kerr Saraiva , Andrei C Sposito. Cardiovascular effects of Glucagon-like peptide 1 (GLP-1) receptor agonists, 2014.10. DOI: 10.1186/s12933-014-0142-7