重度免疫缺陷小鼠,拥有不健全的先天免疫,完全缺乏有功能的T、B和NK细胞,可以用于人源肿瘤细胞移植(CDX)和人源肿瘤组织移植(PDX),以及人外周血单个核细胞(PBMC)及人源造血干细胞(CD34+ HSC)移植进行免疫重建。具有完整免疫系统的小鼠通过强大的先天性和适应性免疫反应迅速清除外来移植的人源细胞,只有免疫缺陷小鼠可以作为异种移植的受体。这种通过重度免疫缺陷小鼠移植人类的细胞或者组织,我们称之为“人源化小鼠”。

免疫缺陷鼠的里程碑发展
无胸腺裸鼠(Nude Mouse)的偶然发现
1962年,病毒流行病学家Norman Grist在格拉斯哥鲁希尔医院的病毒实验室里偶遇一只天然无毛的“裸鼠”。裸鼠缺乏成熟的胸腺和T细胞,在活体实验动物中研究人类肿瘤成为现实。编码叉头蛋白N1(Foxn1)的基因突变导致毛发生长异常和胸腺基质发育缺陷,导致其不会产生成熟CD4+和CD8+T细胞;同时由于缺乏与T细胞的密切接触,裸鼠的B细胞的发育也严重受影响,但是体内仍残留的一些有功能的免疫细胞。
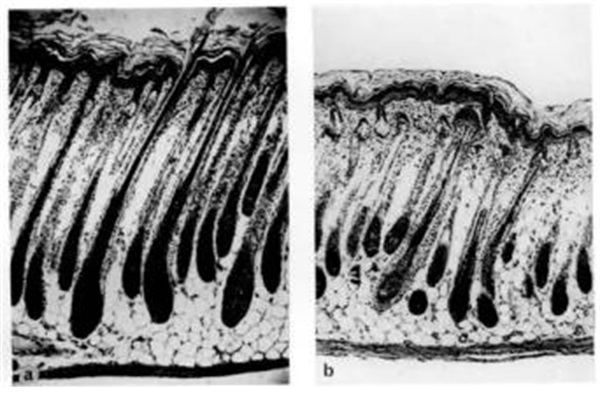
图1. 左图为正常小鼠6天大时背部皮肤纵向切片,显示毛囊有完全角化的毛发;右图为6日龄裸鼠皮肤切片显示毛囊有不正常的角化毛发,在真皮上部弯曲
NOD.CB17-Prkdcscid/J的发现
1983年,Gayle C. Bosma等人发现发现具有严重的免疫缺陷鼠NOD.CB17-Prkdcscid/J,该鼠由于Prkdc(DNA修复酶)突变失活后,T细胞和B细胞受体基因重排过程中VDJ重组被阻断,致使该鼠T细胞和B细胞功能缺失,同时发现其对放疗和某些化疗药物的敏感性高于其他品系。但是老年SCID鼠体内会代偿性的出现有功能的T细胞和B细胞(泄露);其体内保留的有功能的先天免疫系统,比如功能正常的NK细胞也对不利于人源细胞的长期定植。
NOD SCID的发现
1995年,JAX LAB的Lenny Shultz团队在前者工作的基础上将CB17-scid鼠回交到NOD鼠(非肥胖型糖尿病)背景上获得NOD SCID(Non-obese Diabetes-scid)鼠,它既保留了SCID鼠的T细胞和B细胞缺失,又保留了NOD鼠背景上的先天免疫系统(补体系统、NK、DC和巨噬细胞)部分功能的障碍。NOD SCID鼠是目前免疫缺陷程度比较高的一种,但是它残留的NK细胞阻碍人类细胞的长期和系统性的重建。

图2. Lenny Shultz 制备了NOD SCID小鼠
NOG/NSG/NCG鼠的建立
1995-1999的短暂四年间,Cao, X和Jacobs, H等不同实验室团队先后报道:只有靶向破坏编码白介素-2(IL-2)受体的gamma链(Il2rg orγc)才能使在免疫缺陷鼠上持续、系统地重建人类细胞变成可能。此gamma链被IL-2,IL-4,IL-7,IL-9,IL-15和IL-21受体共用,其中最重要的是IL-15信号通路,此gamma链的缺失破坏了NK细胞的发育,有效地抑制了小鼠的先天免疫和适应性免疫功能。
因此该类研究为重度免疫缺陷小鼠提供了较权威的参考意见,日本CIEA在2000年,美国JAX在2007年,集萃药康在2014年完成NCG模型鼠的建立。例如NCG (NOD/ShiltJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt)是使用基因编辑技术敲除了NOD/ShiltJGpt小鼠的Prkdc(Protein kinase, DNA activated, catalytic polypeptide)及Il2rg(Common gamma chain receptor)基因而获得的重度免疫缺陷品系。Prkdc基因功能缺失造成T细胞和B细胞不能发育成熟。IL2RG是多种白细胞介素细胞因子受体的共同亚基,IL2RG失活则导致6种不同细胞因子信号通路缺失,造成NK细胞缺陷。因此,NCG是迄今为止免疫系统缺陷最为彻底的小鼠模型之一,非常适合CDX、PDX、PBMC和CD34+ HSC移植重建。NCG生存周期长(>89周),利于长期移植及药效评价。
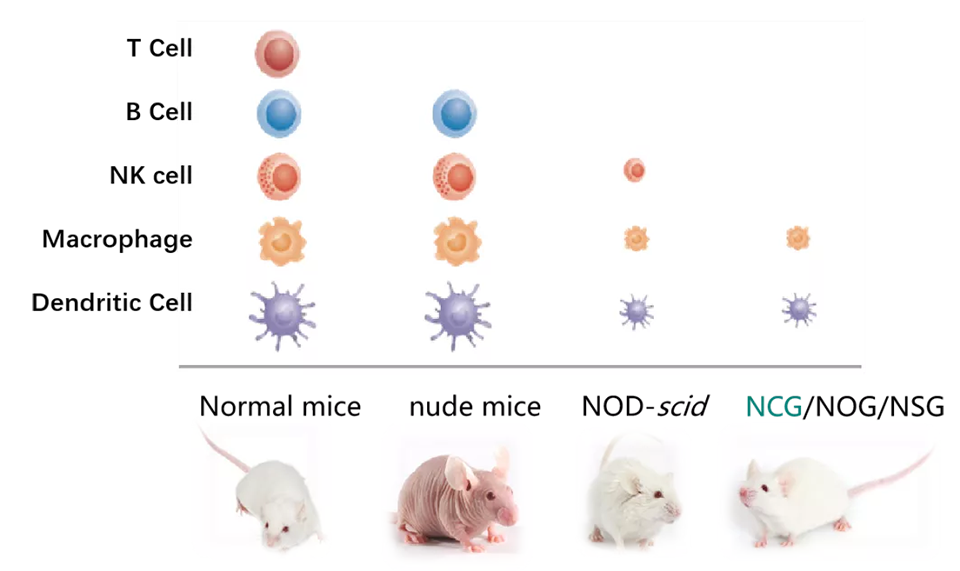
图3. NCG与不同品系免疫缺陷小鼠的免疫细胞分群对比 (图片修改自Pansci.asia)
NCG为什么不在NOD SCID敲除,而在NOD纯背景上敲除?
NOD小鼠自发I型糖尿病,具有天然免疫缺陷,如补体系统、巨噬细胞缺陷等,它的巨噬细胞对人源细胞吞噬作用弱;同时,NOD小鼠的SIRPA与人类CD47亲和力高,NOD比其它品系更适合人源移植物的定植。因而NCG背景纯净,直接源于NOD近交系。
NCG重度免疫缺陷小鼠可用来干嘛?

NCG的应用案例展示
1
验证NCG、NOD与NODSCID 品系脾脏中免疫细胞分布
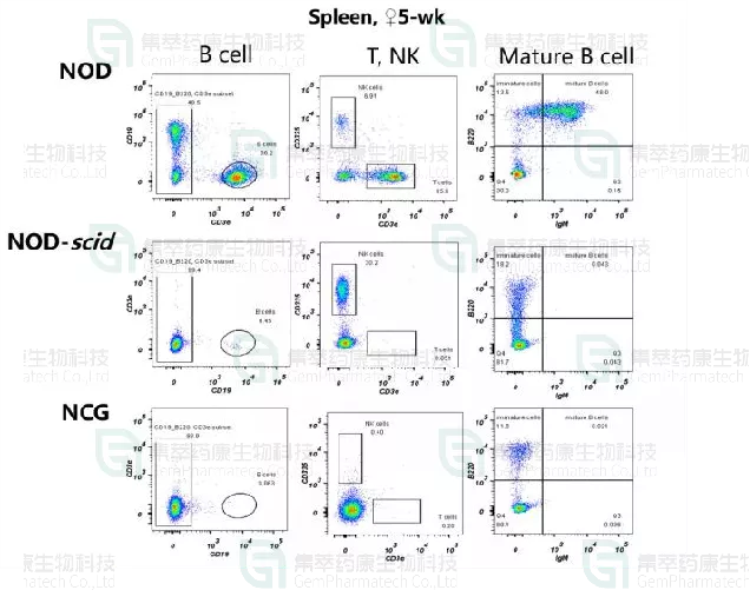
图4. FACS检测不同品系小鼠脾脏中T,B和NK细胞的比例
结果表明:NCG确实是完全缺失T、B、NK细胞和成熟的B淋巴细胞
验证NCG小鼠移植肿瘤细胞系或者肿瘤病样的成瘤性
1CDX模型是将人源的肿瘤细胞移植到小鼠的皮下,用于药效学评价或者肿瘤相关科学研究,是目前抗肿瘤药物临床前药效学评价最常用的体内模型之一。
方法:在NCG鼠上分别接种K56和BT474等人类髓性白血病淋巴母细胞和乳腺癌细胞。结果表明:K56和BT474肿瘤细胞系在NCG小鼠上均有较好的成瘤率。
江苏集萃药康CDX细胞资源库(不单独对外提供;* 已完成成瘤性测试)
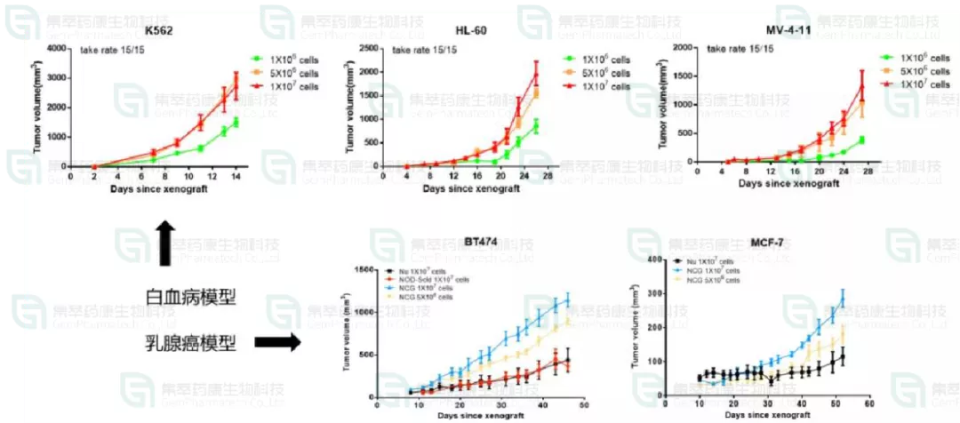
图5. NCG小鼠体内做肿瘤细胞系的成瘤性测试,图中是白血病模型和乳腺癌模型数据。

表1.江苏集萃药康CDX细胞资源库(不单独对外提供;* 已完成成瘤性测试)
(2)NCG-PDX模型
PDX模型是指将病人的新鲜肿瘤组织移植到免疫缺陷小鼠上构建的,较完整地保持患者肿瘤原有的生物学特征、病理分型、分子标志物表达、基因突变类型等。
实验方法:把病人肿瘤样本直接皮下或原位移植到NCG鼠体内建立肿瘤模型(例如图6胃癌和骨肉瘤的PDX模型)。
结果表明:在不传代和改变其遗传性状的前提下较好地保护了肿瘤间质细胞、干细胞和肿瘤微环境成分,较真实地在小鼠体内重现肿瘤的性状和特质。
江苏集萃药康PDX建模:内外部累计建模成功259例(图7)。
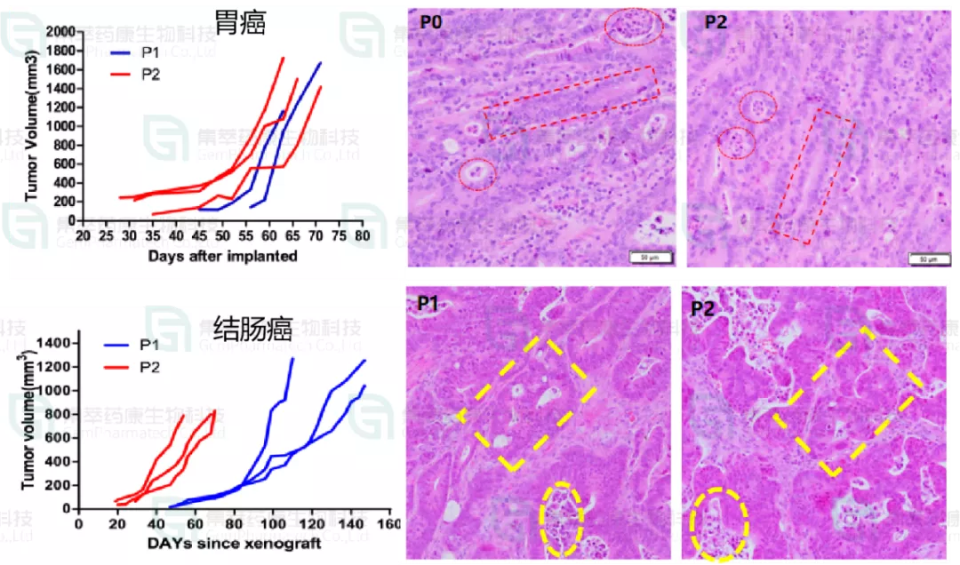
图6. NCG小鼠体内建立胃癌和骨肉瘤的PDX模型。右上红色方框标记的是胃癌的腺管,右下红色箭头标记的骨肉瘤的分裂相。
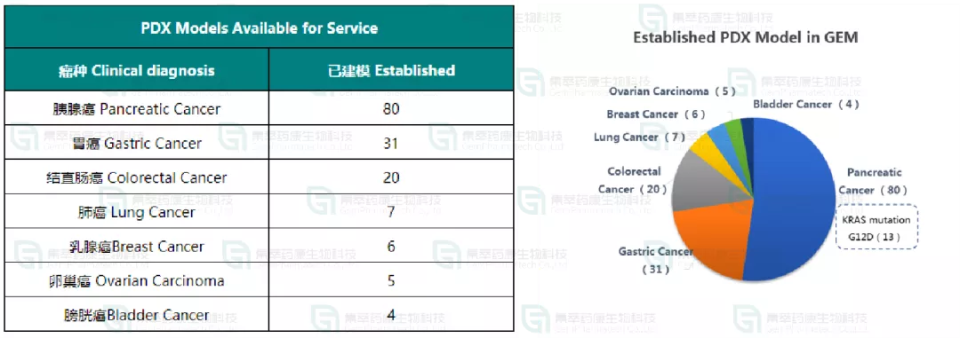
图7. 江苏集萃药康PDX建模已验证成功的259例
3NCG小鼠应用于CAR-T评价
CAR-T(嵌合抗原受体)细胞疗法是肿瘤过继免疫治疗的新方法。CAR的结构包括三部分,即胞外抗原结合区,跨膜区及胞内信号区。CAR-T细胞具有靶向识别肿瘤抗原的能力,其杀伤肿瘤细胞无需进行抗原递呈,与以往免疫疗法相比,具有特异性高、攻击持久等优势。在恶性肿瘤,特别是血液肿瘤治疗中有很好的疗效。
实验方法:在血液瘤细胞系Nalm6制备的成瘤NCG小鼠,给小鼠注射了CAR-T细胞后肿瘤细胞的生长。荧光素酶报告基因luciferase用于活体成像(SI AmX1)。
结果表明:与对照组相比,注射CAR-T细胞后肿瘤细胞的生长受到了显著的抑制。
集萃药康建立的最常用的肿瘤-荧光素酶细胞系库用于活体成像(图8,左),以满足更多科研工作者和客户的需求。
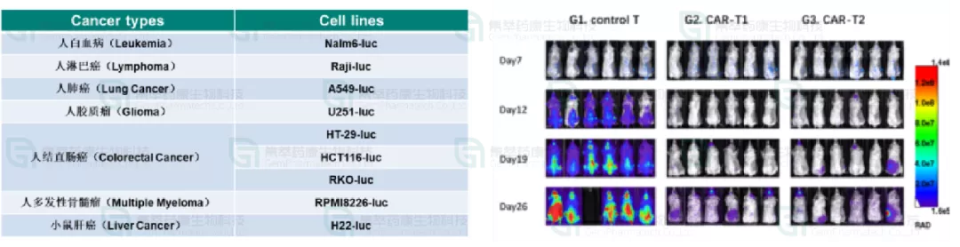
图8. 用于CAR-T测试的荧光素酶标记的癌细胞库和活体数据展示
4NCG小鼠应用于重建免疫系统人源化
集萃药康拥有经过筛选、稳定来源的Donor bank,筛选标准是在NCG模型中免疫重建水平适中,存活周期相对长的小鼠用于后续的药效服务,可以满足一般药效需求。
(1)NCG-hPBMC(Humanperipheral blood mononuclear cells, hPBMCs)
huPBMC-NCG小鼠是将人外周血单个核细胞移植到重度免疫缺陷小鼠NCG体内,从而获得的重建人免疫系统的NCG小鼠模型。
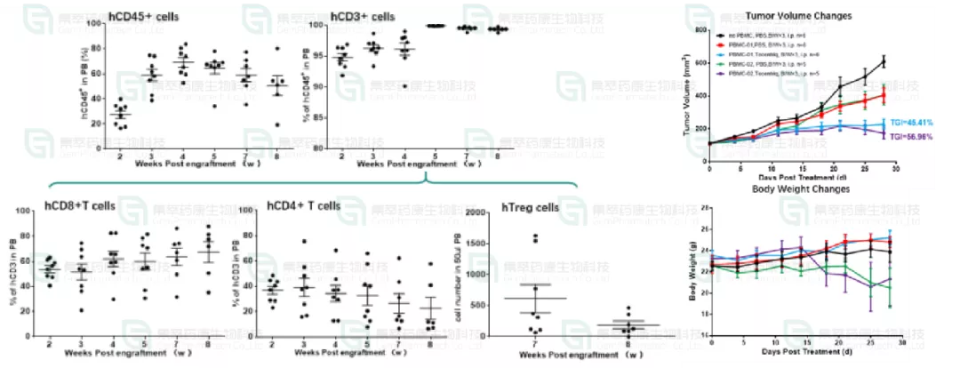
图9. 利用流式细胞技术检测huPBMC-NCG小鼠人源化进程中外周血中白细胞比例,右图为药效评价
结果表明:hPBMC重建后,huPBMC-NCG小鼠外周血中人白细胞的比例逐渐增加,第三周时平均人白细胞比例超过50%。
药效验证:在免疫重建后给小鼠接种MDA-MB-231人乳腺癌细胞系,再给予PD-L1单抗阿替利珠单抗(Tecentriq)以检测重建后的人T细胞是否具备杀伤性(图9,右)。接近50%的TGI数据表明:在NCG小鼠体内用hPBMC重建后的T细胞完全具备杀伤肿瘤的能力。

用人的造血细胞hCD34+ HSC移植到经过辐照的NCG鼠体内做免疫重建的过程,模型构建完成后可以通过CDX或者PDX肿瘤样本或者组织建模,进而给予药物治疗,从而评价药物评价。
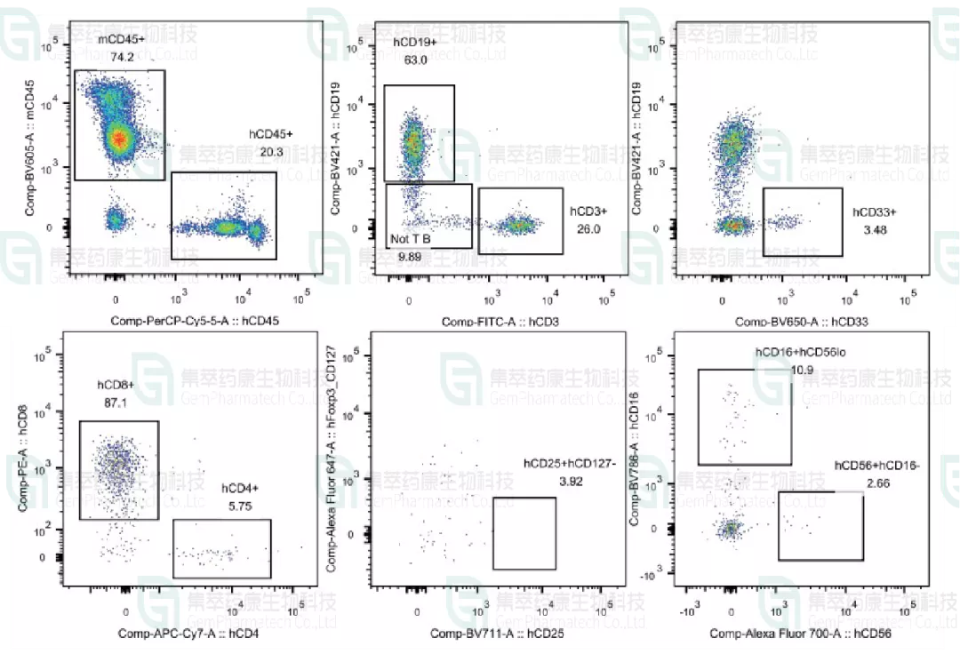
图10. NCG-huHSC小鼠外周血流式分析
结果表明:第16周时对huHSC-NCG小鼠外周血进行流式分析结果显示可在huHSC-NCG小鼠外周血中检测到多种人源免疫细胞,其中人白细胞比例高达50.1%(人白细胞比例高于20%则认为建模成功),表明本研究中huHSC-NCG人源化模型成功建立。

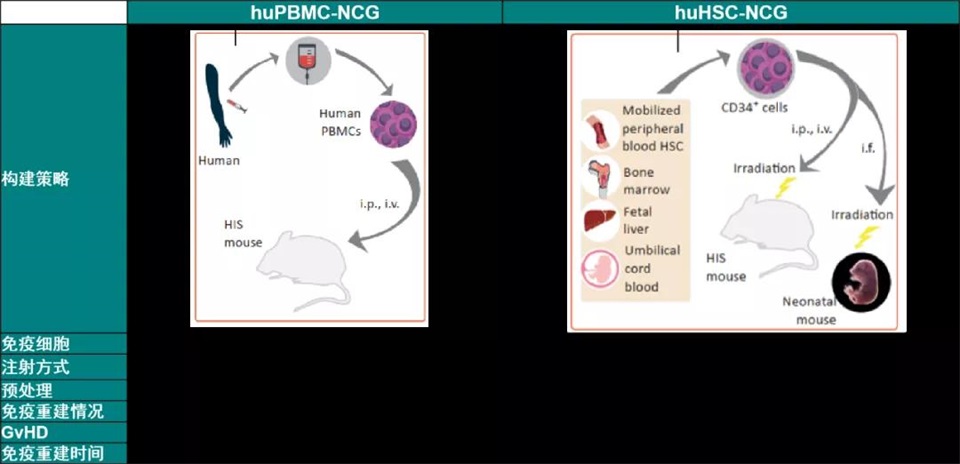
图11. huPBMC-NCG和huHSC-NCG模型的对比[1]
肿瘤微环境由多种免疫细胞和免疫因子共同作用形成,如果人源化小鼠模型只能重建功能性的T细胞,并不能真实地反馈人的免疫细胞,这种药物在临床试验中会造成临床偏差。NK细胞是下一代肿瘤免疫治疗重要的靶标细胞,重建NK细胞免疫系统对于提高药物评价体系非常重要。因此,NCG的一代小鼠模型在一定程度上解决了药物评价的问题,但是人免疫系统的完整性问题亟待解决,集萃药康利用经验丰富的基因编辑平台,在NCG小鼠基础上做了很多二代免疫重建模型。例如HuHSC-NCG-hIL15,完成具有功能的T细胞、NK细胞的NCG小鼠免疫重建模型;为客户解决HSC重建中无法开展辐照清髓的问题,集萃药康构建了Kit点突变的NCG-X小鼠模型等二代小鼠模型。以上我们介绍了NCG小鼠的发展历史和人源化小鼠模型的应用,该小鼠品系助力众多研究者的科研工作[2-15]。我们将在下一期专题中详细讲述。
References
[1]De P et al.(2018)HumanizedMice for the Study of Immuno-Oncology. Trends Immunol. 39(9), 748-763.
[2]Lee S et al. (2017) Clodronate improves survival of transplanted hoxb8 myeloidprogenitors with constitutively active GMCSFR in immunocompetent Mice. Methods&clinicaldevelopment. 7, 60-73.
[3]Wen H J et al. (2018) Recurrent ECSIT mutation encoding V140A triggershyperinflammation and promotes hemophagocytic syndrome in extranodalNK/T cell lymphoma. Nature Medicine, 24, 154-164.
[4]Cao Z W et al. (2017) Targeting the vascular and perivascular niches as aregenerative therapy for lung and liver fibrosis. Science TranslationalMedicine, 9(405), eaai8710.
[5]M Poggio etal. (2019) Suppression of exosomalPD-L1 induces systemic anti-tumor immunity and memory. Cell. 177(2): 414-427.
[6]Ludwik KAet al. (2018) ERα-Mediated Nuclear Sequestration of RSK2 Is Required for ER+Breast Cancer Tumorigenesis. Tumor Biology and Immunology, 10.1158/0008-5472.
[7]Juan H et al. (2019) IRF-7 Is a Critical Regulator of Type 2 Innate LymphoidCells in Allergic Airway Inflammation.CellReports. 29: 2718-2730.
[8]Shultz L D et al. (1995). "Multiple defects in innate and adaptiveimmunologic function in NOD/LtSz-scidmice". J. Immunol. 154 (1): 180-91.
[9]Takenaka Ket al. (2007). "Polymorphism in Sirpamodulates engraftment of human hematopoietic stem cells". Nat. Immunol. 8(12): 1313-23.
[10]GreinerD L et al. (1998). "SCID mouse models of human stem cellengraftment". Stem Cells. 16 (3): 166-177.
[11]CaoX et al. (1995). "Defective lymphoid development in mice lackingexpression of the common cytokine receptor gamma chain". Immunity. 2 (3):223-38.
[12]Wang Z Y et al. (2019) Salinomycinexerts anti‐colorectal cancer activity by targeting the β‐catenin/T‐cell factorcomplex. Br J Pharmacol. 176(17): 3390-3406.
[13]Guo J L et al. (2018) Humanized mice reveal an essential role for humanhepatocytes in the development of the liver immune system. Cell Death Dis.9(6): 667.
[14]Zhang D P et al. (2020) The Agpat4/LPA axis in colorectal cancer cellsregulates antitumor responses via p38/p65 signaling in macrophages. SignalTransduction and Targeted Therapy. 5, 24.
[15]Yin S X et al. (2018) Runx3 Mediates Resistance to Intracellular BacterialInfection by Promoting IL12 Signaling in Group 1 ILC and NCR+ILC3. FrontImmunol. 9: 2101.