2023年7月,上海交通大学医学院何晓敏、张浩及郑景浩共同通讯在国际权威期刊《Science Advances》上在线发表了题为“Targeting gut microbiota–derived kynurenine to predict and protect the remodeling of the pressure-overloaded young heart”的研究论文[1],第一作者为石博中博士。该论文提出犬尿氨酸(Kyn)有望成为检测和防止负荷过大的年轻心脏(poLV)重构的重要指标,并通过临床队列和集萃药康无菌(GF)小鼠模型证明了肠道微生物群与血浆中Kyn浓度增高之间存在关系。

图1 论文信息
心室重构( ventricular remodeling, VR)是一种由各种心血管病因引起的心脏适应不良现象,如果没有及时干预,心室重构会逐渐导致心功能受损并最终导致心力衰竭[2],许多与心室重构相关的病理、代谢和分子改变已在心脏水平得到阐明[3],而最近出现的多组学研究方法使研究者能够以更系统的方式审视心脏疾病。
研究者首先以年龄较小的房/室间隔缺损者为对照组,患左室流出道梗阻(LVOTO)的儿童为实验组,通过非靶向代谢组学分析发现两组的血浆代谢物存在明显差异(图2A),其中犬尿氨酸与心脏重构参数,包括舒张末期左室后壁厚度(LVPWd)、Z评分、左室质量分数(LVMI)、相对壁厚(RWT)和射血分数(EF%)最相关(图2B),这提示研究者Kyn在poLV重构的早期预测中的巨大潜力。
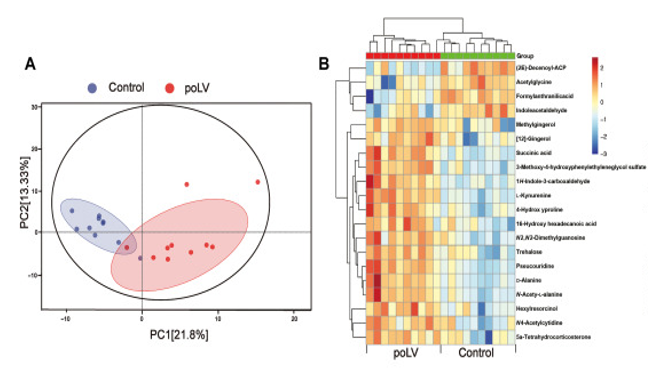
图2 房/室间隔缺损者与左室流出道梗阻患者血浆代谢组学结果图
体外(图3A)和体内(图3B)实验结合单核RNA测序(snRNA-seq)结果(图3C)表明Kyn通过激活芳烃受体(AHR)的易位途经(图3D )来上调心肌细胞肥大和间质纤维化相关基因,从而加重poLV的肥大和纤维化。
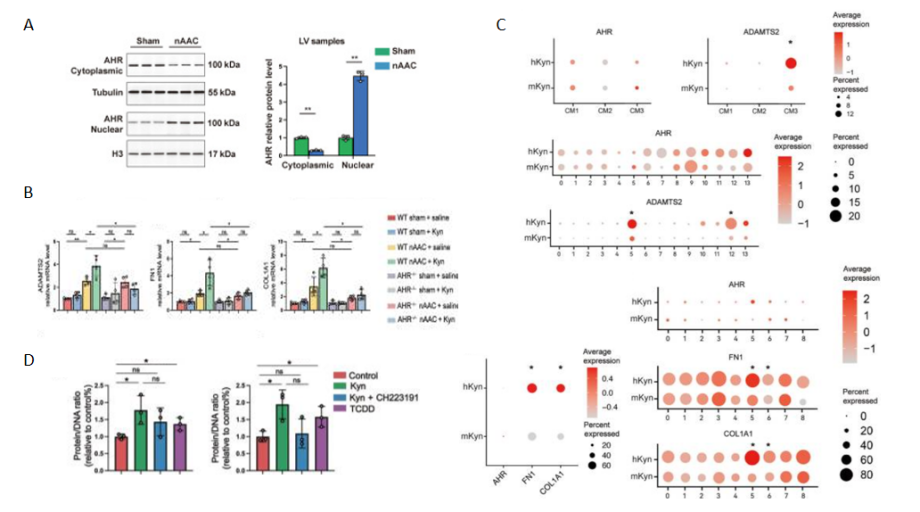
图3 Kyn促进poLV的肥大和纤维化相关机制
Kyn和色氨酸代谢都与肠道微生物群密切相关[4],因此研究人员首先通过16S RNA测序确定4周龄小鼠主动脉收缩模型(nAAC)的肠道发生微生态失调,其中降解色氨酸产生Kyn的关键酶IDO/TDO比率的mRNA在nAAC结肠中的表达较高(图4A),这提示研究者nAAC肠道中Kyn可能会更多表达。研究者随后通过粪菌移植技术将nAAC小鼠的粪菌移植到GF小鼠体内(图4B),验证了nAAC肠道菌群与血浆Kyn水平之间的相关性(图4C),并通过检测验证了双歧杆菌、乳酸杆菌及肠球菌三个菌对血浆中Kyn水平的控制作用(图4D),这说明或许可以通过重塑肠道菌群保护心脏,抑制poLV重塑,这对防止压力负荷过大的年轻心脏重构具有重要意义。
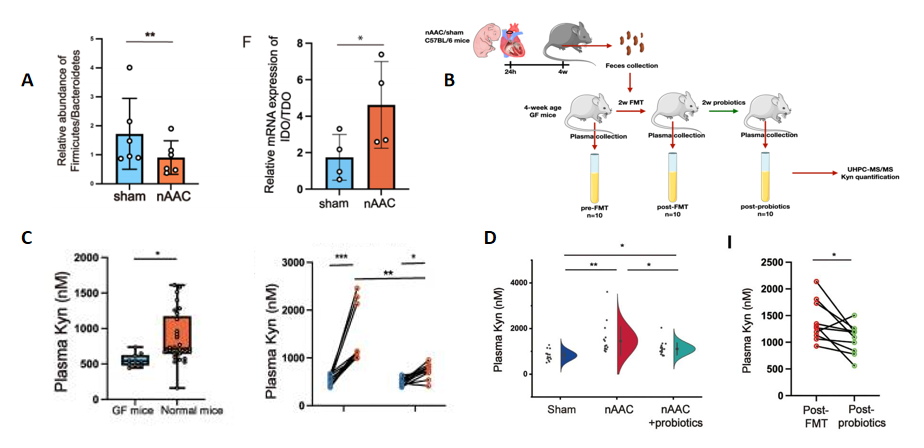
图4 肠道菌群对血浆中Kyn浓度的上调作用及益生菌的干预作用
以粪菌移植(Fecal microbiota transplantation,FMT)为基础的微生物组疗法REBYOTA(RBX2660)和活菌生物药SER-109(VOWST)已在美国获批上市,这意味着利用活菌药/粪菌移植治疗疾病的这个全新模式获得了全球顶级药监机构的认可,且拥有广泛的发展前景。集萃药康无菌鼠与菌群研究服务平台整合了动物模型和微生物技术,拥有国内领先的无菌鼠规模化生产、无菌实验、微生物培养和分析技术,可承接菌群与代谢、菌群与炎症、抗肿瘤药与菌株联合评价、基因与菌群互作、疾病造模等类型项目,实现菌株进,数据出的一站式服务。
[1]Shi B, Zhang X, Song Z, Dai Z, Luo K, Chen B, Zhou Z, Cui Y, Feng B, Zhu Z, Zheng J, Zhang H, He X. Targeting gut microbiota-derived kynurenine to predict and protect the remodeling of the pressure-overloaded young heart. Sci Adv. 2023 Jul 14;9(28):eadg7417.
[2]G. H. Kim, N. Uriel, D. Burkhoff, Reverse remodelling and myocardial recovery in heart failure. Nat. Rev. Cardiol. 15, 83–96 (2018).
[3]J. A. Hill, E. N. Olson, Cardiac plasticity. N. Engl. J. Med. 358, 1370–1380 (2008).
[4]T. Zelante, R. G. Iannitti, C. Cunha, A. De Luca, G. Giovannini, G. Pieraccini, R. Zecchi, C. D'Angelo, C. Massi-Benedetti, F. Fallarino, A. Carvalho, P. Puccetti, L. Romani, Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22. Immunity 39, 372–385 (2013).