红细胞疾病是指主要以红细胞数量明显增减,以及红细胞质量异常为突出的血液学表型的一类疾病,如乙型地中海贫血和遗传性球形红细胞症等。随着基因编辑技术的发展,增加了治愈这些血液病的可能性。通过移植病人的造血干细胞,增加了治愈血液疾病的可能性。然而,这些研究由于缺乏体内评估人类红系分化的合适动物模型而受到极大的阻碍。
目前免疫缺陷小鼠的开发已广泛用于人造血干细胞移植的研究中,尽管人类HSC移植导致人类造血细胞的多个谱系分化,但是HSC移植后由于会被小鼠吞噬细胞吞噬,所以人红细胞无法在免疫缺陷小鼠体内重建。
NCG衍生品系列:助力研究红细胞疾病致病机制和临床前药效评价
针对这个难题,集萃药康制作的NCG-c-kit-Cas9-TM(NCG-X:T003802)小鼠,以NCG免疫缺陷鼠为背景,利用cas9技术引入了W41点突变。C-kit原癌基因编码蛋白是一种祖/干细胞生长因子受体(SCFR),又称为CD117,作为细胞因子受体,在造血祖细胞由骨髓迁移至血浆的信号通路中c-kit蛋白起重要作用。该点突变的小鼠会出现自发贫血的症状,其造血干细胞功能受到明显抑制。该品系具有T/B/NK细胞免疫缺陷,同时造血干细胞功能抑制。无需接受辐射即可接受人造血干细胞移植,在骨髓中可重建出高水平的人的红细胞。可用于研究红细胞疾病相关的致病机制和临床前药效评价。目前NCG-X小鼠在工业界和学术界都已经得到了广泛认可。(已发表文章:Epigenetic inactivation of ERF reactivates γ-globin expression in β-thalassemia)
01 NCG-X小鼠红细胞检测
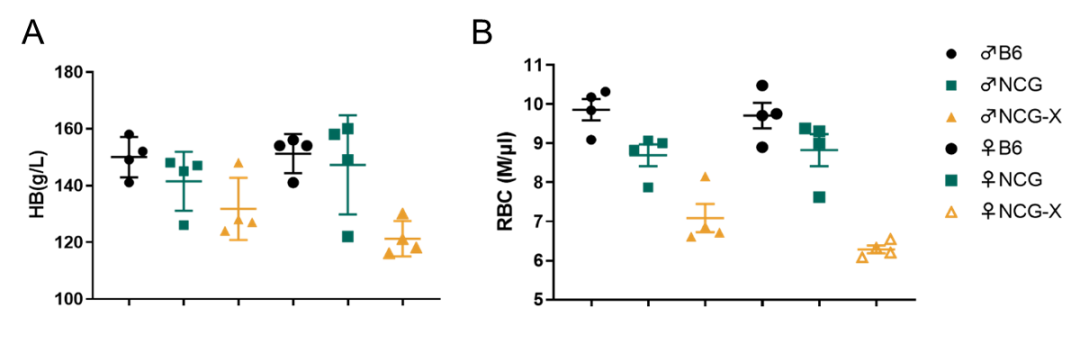
图1 NCG-X小鼠红细胞检测
收集8周龄小鼠外周血检测血红蛋白和红细胞,结果表明NCG-X小鼠红细胞数量及血红蛋白水平显著减少(1A、B)。说明c-kit基因突变抑制了NCG-X小鼠红细胞发育。
02 NCG-X小鼠HSC CD34+重建
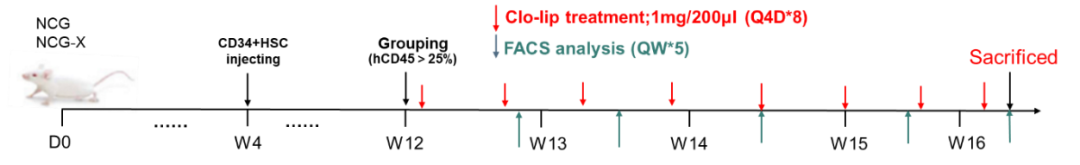
图2.小鼠红细胞重建实验方案
将HSC CD34+分别移植到NCG-X小鼠中。由于小鼠的巨噬细胞对人的红细胞具有吞噬作用,第12周开始注射氯磷酸二钠脂质体Clo-lip(Clo-lip可清除小鼠外周血中的巨噬细胞,骨髓中发育的成熟红细胞进入外周血),从而在外周中重建出人的成熟红细胞。
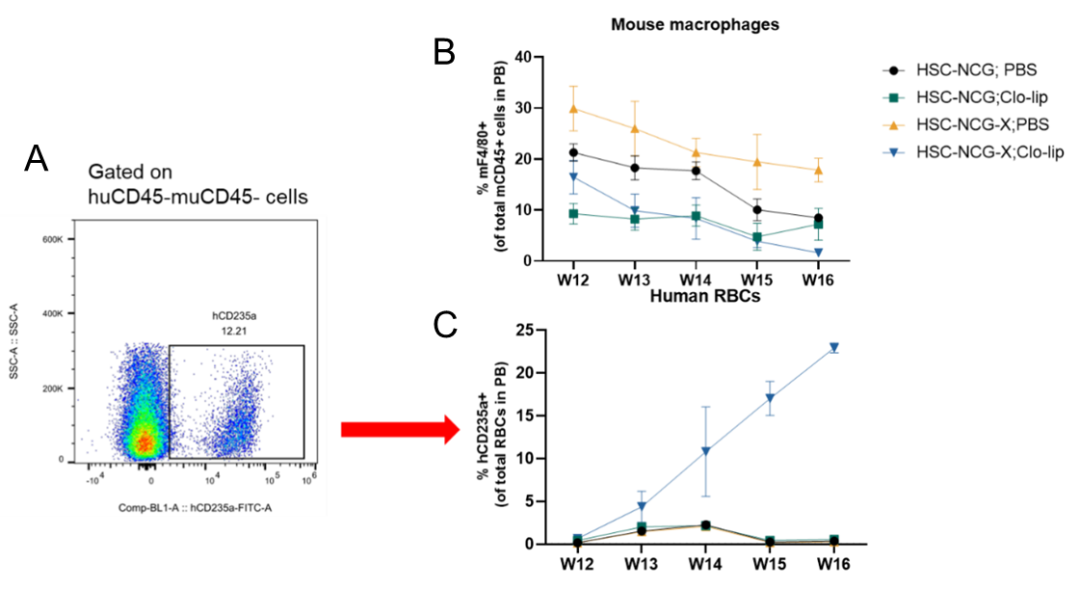
图3.小鼠外周血人红细胞和小鼠巨噬细胞检测
给予Clo-lip后小鼠外周血鼠源巨噬细胞逐渐降低(3B);与huHSC-NCG小鼠相比,huHSC-NCG-X在clo-lip清除鼠源巨噬细胞后外周血中重建出较高水平的人源红细胞,随着重建进程,在16周达到总红细胞比例的25%左右(3A、C),显著高于huHSC-NCG品系。
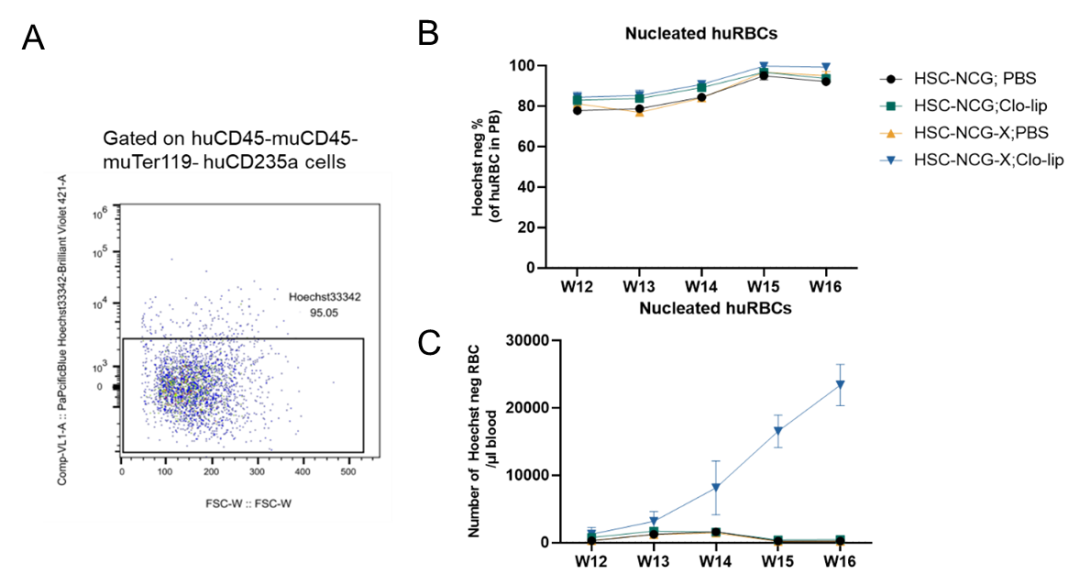
图4.小鼠外周血中成熟红细胞检测
给予Clo-lip后,huHSC-NCG-X在外周血中重建的红细胞主要为去核成熟红细胞(4B);同时huHSC-NCG-X在外周血中重建去核人红细胞的重建数量持续增加(4A、C)。
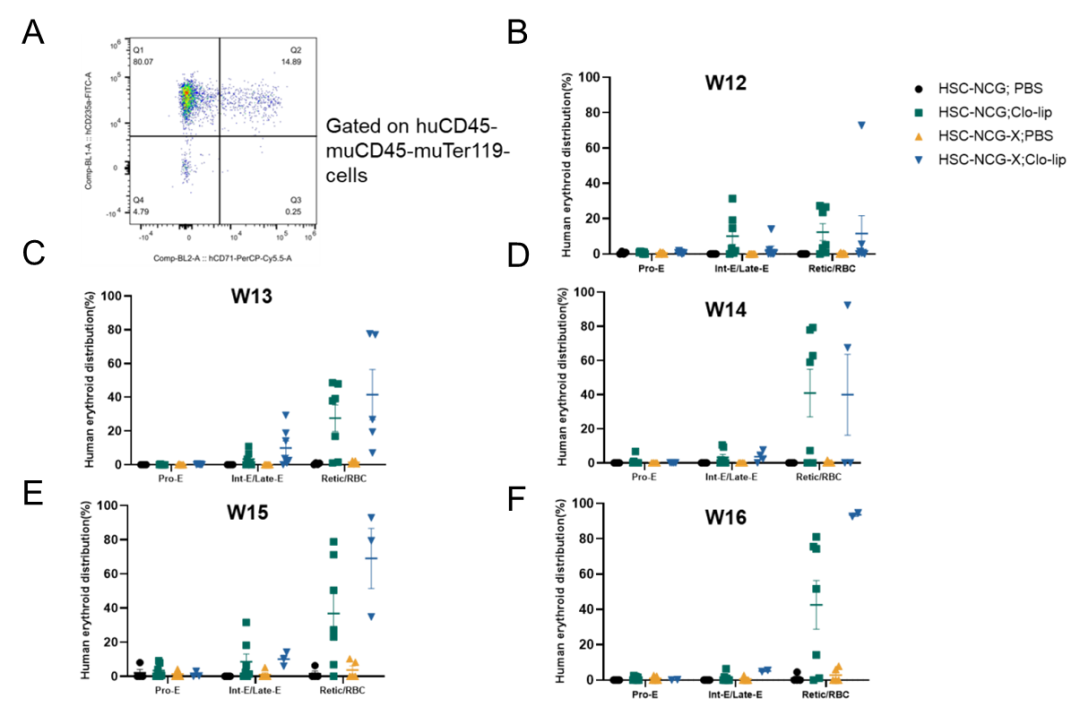
图5.小鼠外周血分型红细胞比例检测
给予Clo-lip后不同重建周龄的小鼠人Retic/RBC网织红细胞和成熟红细胞相较于Pro-E早期红细胞和Int-E/Late-E中期和晚期红细胞比例升高(5A、B、C、D、E、F)。说明在不同重建周龄外周血中的红细胞趋向于向成熟红细胞分化。

图6.终点骨髓红细胞检测
HuHSC-NCG-X小鼠骨髓总的人红细胞以及去核红细胞相较于huHSC-NCG小鼠比例显著升高(6B、C),huHSC-NCG-X小鼠骨髓总的红细胞较于huHSC-NCG小鼠比例下降(6A)。同时huHSC-NCG-X的Int-E/Late-E中期和晚期红细胞比例和Retic/RBC网织红细胞和成熟红细胞比例也有升高的趋势(6D)。
综上,huHSC-NCG-X小鼠相较于huHSC-NCG小鼠更有利于骨髓和外周血红细胞的重建,是红细胞疾病临床前研究不可多得的“知音”。
[1]Nocka, Karl, et al. "Molecular bases of dominant negative and loss of function mutations at the murine c-kit/white spotting locus: W37, Wv, W41 and W." The EMBO journal 9.6 (1990): 1805.
[2]McIntosh, Brian E. et al. “Nonirradiated NOD,B6.SCID Il2rγ−/−KitW41/W41(NBSGW) Mice Support Multilineage Engraftment of Human Hematopoietic Cells.” Stem Cell Reports 4.2 (2015): 171–180. PMC. Web. 30 June 2017.
[3]Waskow, Claudia, et al. "Hematopoietic stem cell transplantation without irradiation." Nature methods 6.4 (2009): 267-269.
[4]Smith, Elizabeth R. et al. “White Spotting Variant (Wv) Mouse as an Experimental Model for Ovarian Aging and Menopausal Biology.” Menopause (New York, N.y.) 19.5 (2012): 588–596. PMC. Web. 17 July 2017.
[5]Yang, Wan-Lin et al. “A Reduction of Cyclooxygenase 2 Gene Dosage Counters the Ovarian Morphological Aging and Tumor Phenotype in Wv Mice.” The American Journal of Pathology 170.4 (2007): 1325–1326.