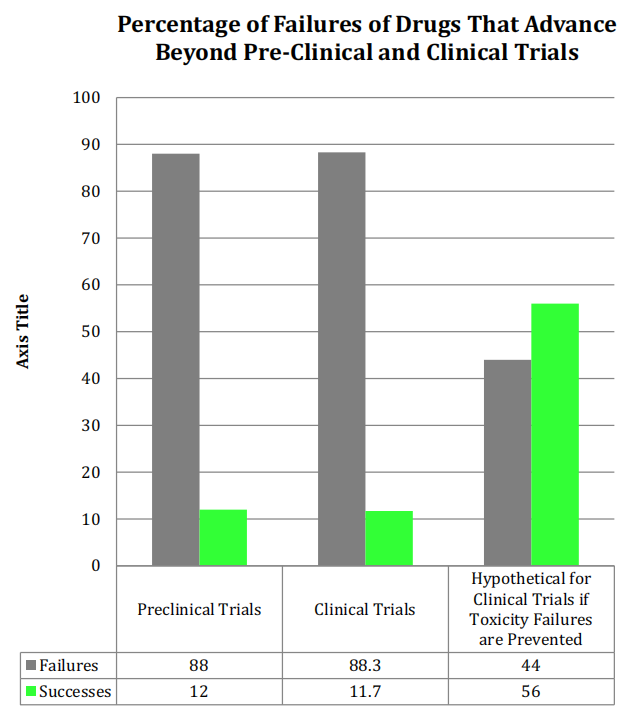
动物试验是药物临床前测试的关键一步,但一些研究分析表明动物模型不能很好预测人类药物的安全性。据相关数据统计,大约88%的新药未能通过人体临床实验。一个重要的原因是很多在动物实验中被测试为安全的药物,在临床试验中却会使受试者产生诸多不良反应症状。如果可以在临床前试验阶段,通过动物毒性试验排除会对人产生毒性的药物,临床试验的成功率将从11.7%上升到约56%[1-2]。
研究报道,遗传多样性在药物反应评价中有着非常重要的作用。据估计,药物反应中95%的药代动力学和药效学的差异可以用遗传学来解释,药代动力学和药效学的评价中出现的药物不良反应(ADR)也与遗传变异直接相关。目前常用的近交系小鼠模型,其经过多代的人工选择和饲养,许多致病基因被选择淘汰,缺乏遗传多样性,在药物评价中可能缺失某些受遗传特征影响的反应,降低了药理学和毒理学终点测量中的噪声,一定程度上影响了药物评价的结果 [3-4]。
因此,开发一种新型的、更适合模拟人类进行临床药物评价的模型是很有必要的。具有更丰富的遗传多样性的小鼠群体可用于帮助减少药物在临床前研究和临床研究之间的不一致性,并更全面地模拟受遗传因素影响的毒性反应[4]。
那么,如何开发这样一种既存在多样性,又可以很好应用于药物研发的小鼠呢?
——“野化鼠”可能就是这个答案
与实验室的近交系小鼠不同,野生鼠生存在真实的自然环境中,需要适应各种环境压力,因此野生鼠具有更多的遗传多样性。事实上,也有相关研究报导,野生小鼠具有不同的传染性疾病易感性[5-6]。因此,野生鼠或许能成为更好的人类“仿真替身”,用于临床前药物测评,更好地反映出药物的不良反应。
但野生小鼠具有来源不稳定、存在微生物风险以及繁育难度较大等问题,在具体开展研究工作时,材料难以保障。同时,在研究某个特定性状或某种疾病时,野生小鼠过于复杂的基因背景会大大增加分析难度。那么,如何克服这些难点,构建应用性更强同时又满足遗传多样性要求的实验小鼠呢?
一个比较好的方式就是构建染色体置换系(CSSs)。以野外捕捉的野生小鼠作为遗传材料供体,通过不断与近交系小鼠交配和筛选,培育出仅有一条染色体与近交系不同的新的近交系。为了保证野生来源的染色体在回交过程不因发生基因重组而被稀释,所以使用了平衡染色体技术(染色体倒置,防止同源染色体在减数分裂过程中发生交叉互换),这样就能培育出包含野生鼠不同染色体的置换系小鼠,从而获得丰富的遗传小鼠材料。
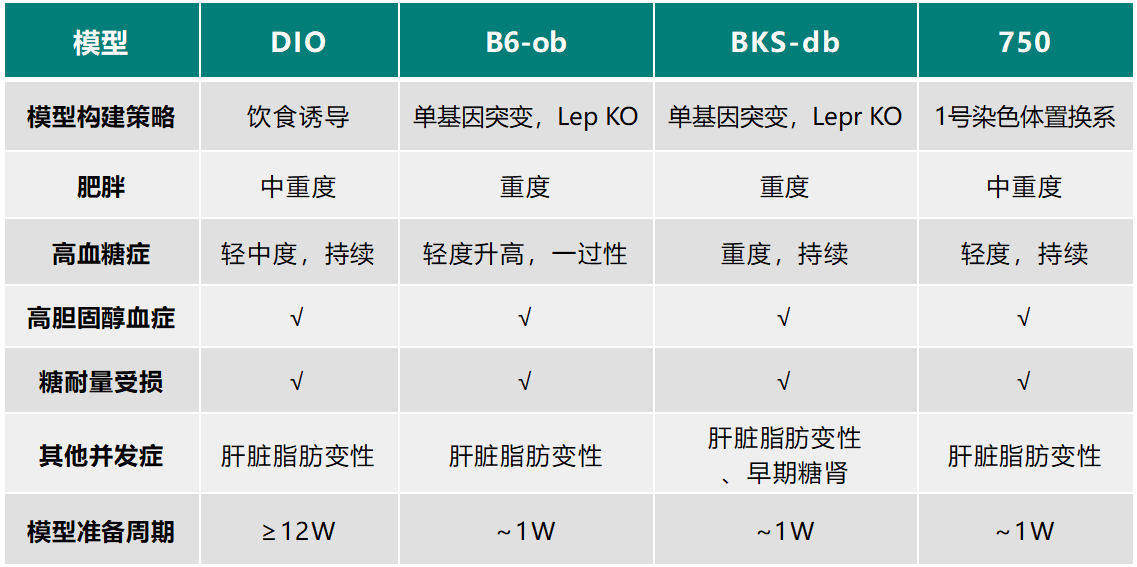
集萃药康正在构建一系列的染色体置换系小鼠,这是一项长期而艰巨的任务,但我们有信心进行到底。目前我们已经获得了野生鼠1号染色体置换系小鼠(以C57BL/6J小鼠作为受体),通过体重、血糖、血生化、行为学等表型初筛,我们发现了一些对疾病易感的小鼠品系。通过进一步的数据验证,我们找到一个具有显著代谢异常表型的品系——750野化鼠(品系全称:B6-Chr1YP1,品系编号:D000750)。常规饮食(非高脂饮食诱导)8周后750胖墩鼠即表现出自发肥胖表型,并且胆固醇水平显著升高,同时瘦素和胰岛素也明显升高,表现出一定程度的瘦素和胰岛素抵抗。与现有的疾病模型(DIO、BKS-db、B6-ob)相比更接近人类肥胖病程的发展,可应用于肥胖、高血脂、脂肪肝等代谢性疾病的研究。
750小鼠表型数据展示
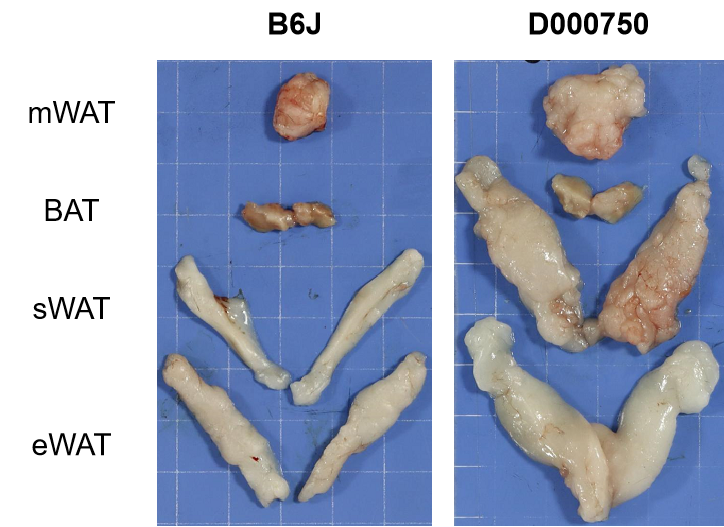
750与B6J小鼠不同组织脂肪观察,750小鼠各部分脂肪组织明显多于B6J小鼠。肠系膜(m)、皮下(s)、附睾(e)、白色脂肪组织(WAT)、棕色脂肪组织(BAT)。
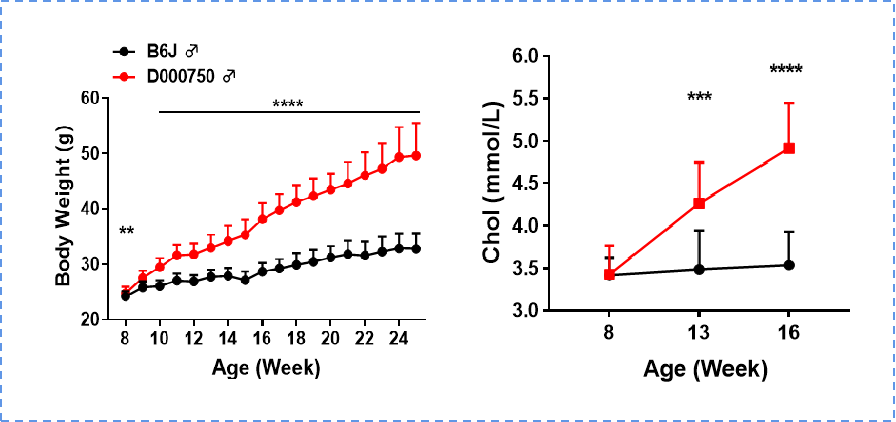
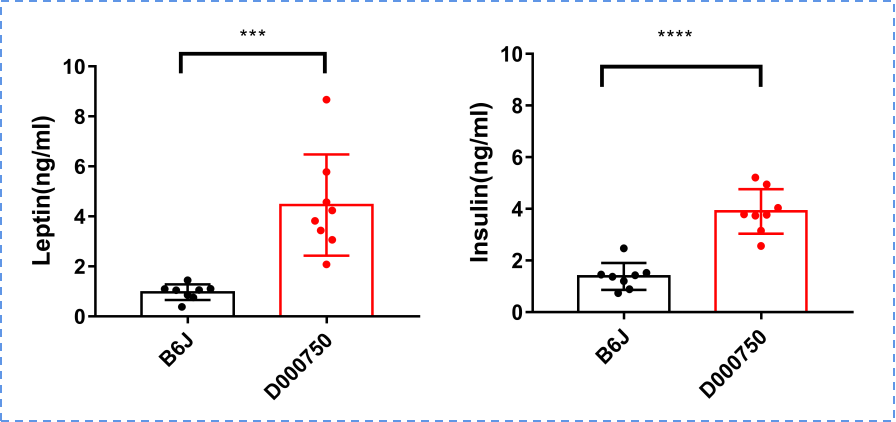
750小鼠与B6J小鼠相比,体重、总胆固醇、瘦素及胰岛素水平显著升高。
常见的涉及肥胖的基因包括Lep(ob)、Lepr(db)、Alms1、FTO等等,但这些基因在人当中发生突变的概率非常之低。而DIO造模时间较长,延长整个实验周期,且喂养饲料间的差异也会使得模型个体间存在一些差异。而750小鼠无需高脂诱导,同时引入了自然突变,增加了遗传多样性,为解析新的信号通路和疾病机制提供了新资源,也为临床前相关药物评价提供了新的模型选择,为降低临床前与临床药物测试差异带来新的契机。
各类肥胖模型比对
期待野化鼠在未来药物研发中发挥更大价值~
参考文献:
1. Van Norman GA. Phase II trials in drug development and adaptive trial design. J Am Coll Cardiol Basic Trans Science. 2019;4:428-37.
2. Van Norman GA. Limitations of Animal Studies for Predicting Toxicity in Clinical Trials. JACC Basic Transl Sci. 2019 Nov; 4(7): 845-854.
3. Aamir Zuberi and Cathleen Lutz. Mouse Models for Drug Discovery. Can New Tools and Technology Improve Translational Power. ILAR Journal, 2016, Vol. 57, No. 2, 178-185.
4. Merrie Mosedale. Mouse Population-Based Approaches to Investigate Adverse Drug Reactions. Drug Metab Dispos. 2018. 46:1787-1795.
5. Xu FY, Chao TZ, Liang YM, et al. Genome Sequencing of Chromosome 1 Substitution Lines Derived from Chinese Wild Mice Revealed a Unique Resource for Genetic Studies of Complex Traits. G3 (Bethesda). 2016 Nov 8;6(11):3571-3580.
6. Phifer-Rixey, M, and M. W. Nachman. Insights into mammalian biology from the wild house mouse Mus musculus. eLife. 2015, 4: e05959.