物理因素大小鼠失眠模型的构建方法
触碰法指通过轻柔触碰动物、晃动或拍打鼠笼以干扰动物的睡眠造成动物失眠的方法。 触碰的方式可为人工手动触碰,也可利用仪器,选取毛刷、杠杆或木棒进行自动触碰;晃动笼具既可手动摇晃,也可将其放在摇床或可移动的平面上以达到使动物保持清醒的目的。 该方法具有刺激强度小、对动物干扰小的优点,且无持续性压力。 人工干预的方法较易实施,但对实验者的专注力、体力要求较高,只适合短时间造模。 若采用仪器进行自动干扰,短期或长期造模均可。 Wallace 等利用此方法研究睡眠碎片化对小鼠的影响。 动物放入含杠杆的鼠笼中,杠杆每2 min 自动转动10s,当触碰到动物时,动物被唤醒。 脑电监测结果显示,这一过程中动物的非快动眼睡眠( nonrapid eye movements sleep,NRMES) 和快动眼睡眠( rapid eye movement sleep,REMS) 时间显著减少,觉醒次数明显增加。研究多利用此方法观察不同处理的小鼠在短时睡眠剥夺后,睡眠恢复的差异性。 现已成为最常用的睡眠剥夺方法。
平台水环境法的原理是动物进入 REM 睡眠后肌肉张力消失,从平台掉落水中惊醒,造成 REM 睡眠剥夺。 造模方法为将动物放在实验箱内直径较小的平台上,平台对于小鼠多设定为直径约 2 cm、高约5 cmꎻ对于大鼠直径约 6 5 cm,高约 8 cm。 实验箱内注入自来水,水面高度距离平台面约 0 5 ~ 1 cm。
此方法包括:
( 1) 单平台法即实验笼内仅设置一个平台,可避免动物相互干扰,但会造成单笼饲养的隔离应激,甚至出现社交障碍;
(2) 多平台法可同时进行多只动物的 REM 睡眠剥夺 ,并且动物可在各平台上自由活动,故多平台法应用较广泛。 该方法可针对性剥夺REM 睡眠,缺点是若造模时间过长或强度过大,可能出现动物掉落水中因体力不支无法返回平台而死亡的现象。 故不适合长期且高强度造模[7] 。 Machado 等[8] 应用直径为65cm 的平台,对大鼠进行单平台法和多平台法的睡眠剥夺,发现在造模期间,两种方法不仅能基本完全剥夺动物的REM 睡眠,更显著减少慢波睡眠。
滚筒法( 转轮法) 的原理是将动物放入滚筒等装置中,装置自动旋转,动物被迫随装置转动而运动,导致无法入睡或短暂睡眠后觉醒。 实验除设有对照组和睡眠剥夺组外,常增加强迫运动组,目的在于排除运动对动物睡眠相关指标的影响。 强迫运动组的装置转速多设置为睡眠剥夺组的两倍,时间减少一半,保证充足的睡眠。 此方法的特点为造模强度大,可实现完全睡眠剥夺,重复性和可靠性高,但对动物的体力消耗大,对仪器的稳定性要求较高。 Dispersyn 等 将小鼠放入滚筒( 外径 35. 6 cm,内径 20 9 cm) 中,滚筒以 3 m / min 转 3 s,停 12 s 的方式自动旋转,以探究睡眠剥夺 24 h 和恢复期48 h 内小鼠睡眠的变化。 结果表明小鼠24h内觉醒时间达97%,恢复期第1 天7:00 ~ 19:00,小鼠 NREM 和 REM 睡眠明显反弹。
除触碰法、平台水环境法和滚筒法外,水上网格法、水上转盘法等也可应用于失眠动物的造模,但据近十年文献统计发现已较少应用。
慢性不可预知温和应激模型 ( chronic unpredictable mild stress,CUMS) ,早期又名慢性温和应激模型( CMS) ,由 Katz 等于1981 年首先建立。 造模期间动物历经潮湿垫料、空瓶、禁食、冰水游泳、热水游泳、夹尾、昼夜颠倒、电击等操作,最终造成快感缺失、焦虑、抑郁和学习记忆障碍等[12] 。此模型大多用于焦虑、抑郁、认知等方面的研究,也有研究显示其会对睡眠造成影响。 Mou 等[13] 对 SD大鼠进行28 d 的慢性不可预知温和应激后,向大鼠腹腔注射50 mg / kg 戊巴比妥钠,观察到模型大鼠的睡眠时间显著缩短。 Nollet 等[14] 对小鼠进行 9 周的 CUMS 造模,并间隔进行脑电监测。 结果显示,造模仅3 d 即可使小鼠的 REMS 时间显著增加,并持续至造模结束ꎻNREMS 在整个周期内时长无显著变化,但呈碎片化。
束缚是将动物放入狭小的束缚装置中,限制动物的运动空间和范围,造成心理和生理的双重压力,具有简单易操作、无痛且持久的特点[15] 。 慢性束缚不仅使动物情绪、学习记忆等行为学指标、炎症指标发生变化[16-17] ,也可造成睡眠障碍。 陆婷婷[18] 将 ICR 小鼠放入 50 mL 离心管制成的束缚器中,进行3、5 或7 d 的束缚造模,每天9 h 或12 h,并于束缚结束后腹腔注射戊巴比妥钠诱导动物入睡,观察睡眠潜伏期和睡眠时间。 束缚后的各组小鼠睡眠潜伏期均延长、睡眠时间均缩短,以每天束缚 9 h,持续7 d 最为显著。 Yasugaki 等[19] 对 C57BL / 6J小鼠进行3 周的浸水和束缚实验,将小鼠放入束缚管内,垂直放入水中。 每天 2 h,每周 6 d,并于各周第7 天进行脑电监测。 小鼠在给予1、2 和3 周的压力刺激后 24 h 内均显示出觉醒时间减少,NREMS和 REMS 时间增加,其中第1 周结果最显著,同时伴随 REMS 次数明显增加。
慢性社会挫败动物模型模拟人在社会环境中因社会地位等问题产生的心理压力,最终导致社交恐惧和兴趣缺失[20] 。 动物模型常采用 C57BL / 6J 小鼠,将其放入 CD1 小鼠的笼中,因 CD1 小鼠的领地中突然出现其他动物,会攻击 C57BL / 6J 小鼠。 造模一般采用每天攻击 10 min,其余时间用透明隔板隔开的方式。 该方法不仅会引起动物的社交障碍,同时 会 改 变 其 睡 眠 节 律。 Henderson 等 对C57BL / 6J 小鼠进行 10 d 慢性社会挫败造模,在第 1、3、10 天进行脑电监测。 结果显示 1、3、10 d 社会挫败后 3 h 内觉醒时间显著增加,REMS 时间显著减少,NREM 睡眠减少ꎻ造模后 10 ~ 22 h 出现睡眠反弹,觉醒时间极显著减少,NREM 睡眠极显著增加,REM 睡眠增加。 Wells 等[22] 同样用 C57BL / 6J小鼠造成社会挫败模型,并每日监测脑电变化。 发现造模期间,模型组REMS 平均时间显著增加,在第 4、5、6、7、9 天与对照组有显著性差异,REMS 次数对应增加。慢波睡眠时间也呈上升趋势,同时伴随觉醒时间减少。
空瓶刺激模型由林文娟等建立,指动物经过定时喂水训练后,形成条件反射,随后进行不定时空瓶刺激,1d内1~2 次,以诱发其情绪应激。 于鑫应用慢性情绪应激造大鼠失眠模型。大鼠经历10d定时喂水训练后,进行14d空瓶刺激,应激后大鼠睡眠总时间、慢波睡眠、REM 睡眠均缩短。
电击是可使动物产生恐惧的压力源,大量研究表明其会对动物的睡眠产生影响。 王芳等通过电刺激造大鼠失眠模型,参数为电流 0 5 mA,频率 1 Hz,刺激 30s间隔30min,观察到8h电刺激后SD大鼠睡眠总时间、慢波睡眠、REM 睡眠均减少,觉醒时间增加。Yan 等 也应用相同参数电击造模,观察大鼠经受刺激前后睡眠的变化,结果与上述研究一致。
触碰法、平台水环境法和滚筒法模拟因为外界环境干扰所致的睡眠不足,根据造模时间可造成完全睡眠剥夺或部分睡眠剥夺,使动物表现出以睡眠时间减少为特征的失眠症状。 慢性不可预知温和应激、慢性束缚、慢性社会挫败、空瓶刺激和电击是通过心理和生理的双重应激,造成动物睡眠障碍,普遍表现为觉醒时间增加,睡眠时间减少。 然而,经历慢性社会挫败应激的动物多表现为睡眠时间增加。 此外,创伤后应激、冲突性心理应激也可造成动物睡眠障碍,出现失眠症状。
化学因素大小鼠失眠模型的构建方法
1、对氯苯丙氨酸诱导失眠模型
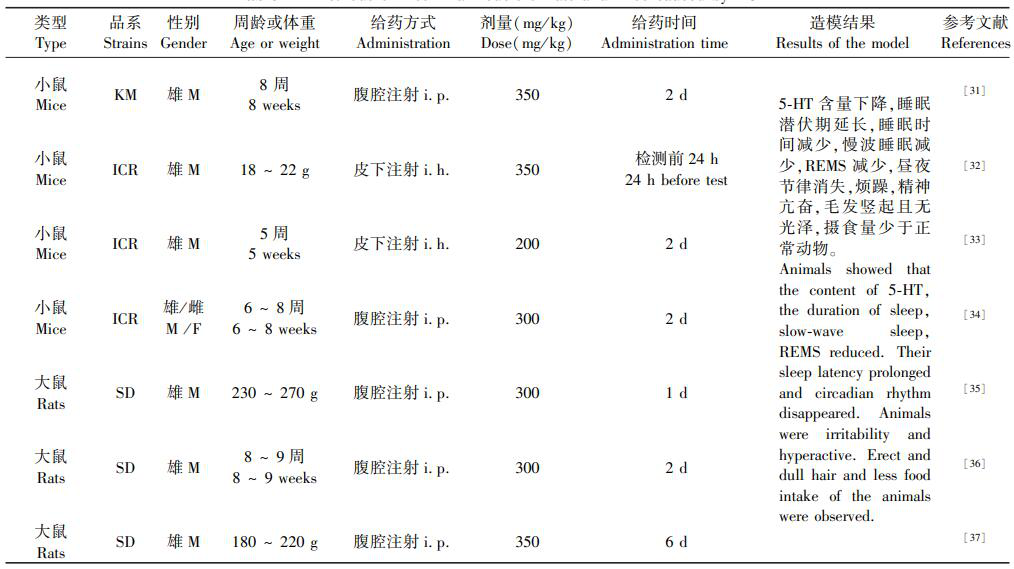
对氯苯丙氨酸(4-chloro-DL-phenylalanine,PCPA)是色氨酸羟化酶的选择性和不可逆性抑制剂,色氨酸羟化酶是合成5-HT的起始酶和限速酶。5-HT 已被证实在睡眠-觉醒的调节中发挥重要作用,而PCPA可有效阻断95%以上5-HT合成。腹腔注射PCPA造成失眠模型,常用的剂量为300 ~ 500 mg/(kg·d),连续注射1~3d。注射PCPA后,动物体内5-HT在至少7d内维持较低水平,9d后可基本恢复正常。该方法造模成功率高,稳定性好,动物出现的失眠症状与人类相似,目前已广泛用于失眠动物实验的研究。本文从动物品系、周龄或体重、给药剂量和方式等方面总结近几年PCPA造成大小鼠失眠模型的方法,见表1。
表1:PCPA 造大/ 小鼠失眠模型的方法
Table 1 Methods of insomnia models of rats and mice caused by PCPA
2、 咖啡因诱导失眠模型
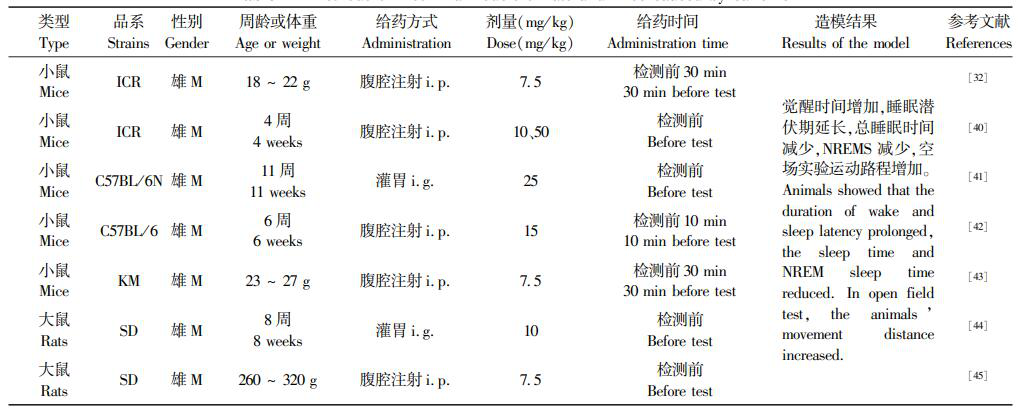
咖啡因是腺苷A,和A2,受体的拮抗剂,其对二者的亲和力相似,无选择性。咖啡因在体内进一步被代谢为黄嘌呤和茶碱,其代谢物可更有效地拮抗A,和A2受体。腺苷通过与A,和A2,受体结合发挥促进睡眠的作用,故摄入咖啡因后会对睡眠造成影响。该方法非常经典,具有安全性高、成本低、作用明确的优点。但腺苷A2受体基因的功能多态性会导致咖啡因损害睡眠质量的个体差异[],造成实验数据波动较大。咖啡因的造模剂量多选用 5 ~15 mg/kg,也可使用 25、30 或 50 mg/kg 等较高剂量。在睡眠实验检测前 30 ~ 60 min 腹腔注射咖啡因,可成功影响动物的睡眠。总结近几年采用咖啡因造模的文献,如表2所示。
PCPA和咖啡因造模都会导致动物觉醒时间增加,入睡潜伏期延长和睡眠时间减少,其中REMS、NREMS 均减少。除腹腔注射 PCPA 和咖啡因外,给予动物乙醇,形成乙醇依赖,戒断后可造成动物觉醒时间增加,REM、NREM睡眠时间显著减少。
中枢微量注射去甲肾上腺素、食欲素或促肾上腺皮质激素释放激素等,皮下注射阿朴吗啡、氟西汀或育亨宾等同样可导致动物失眠。
表 2 咖啡因造大/ 小鼠失眠模型的方法
Table 2 Methods of insomnia models of rats and mice caused by caffeine
病理因素大小鼠失眠模型的构建方法
慢性疼痛常引发失眠,现常采用坐骨神经部分结扎造神经痛模型,研究动物睡眠的变化。模型动物表现出觉醒时间、次数增加,NREM、REM睡眠时间及次数减少。
此外,精神类疾病如抑郁症、焦虑症、创伤后应激综合症、癫痫、自闭症等也会引发失眠,高血压、缺血性中风同样会抑制睡眠。
根据研究目的不同,常采用多种诱因的复合因素造成失眠模型。应用线栓法(MCAO)和PCPA联合造模研究脑缺血后睡眠障碍,双侧颈总动脉闭塞(BCCAO)和平台水环境法造模研究慢性脑缺血伴发失眠,去势或卵巢切除联合电刺激或触碰等方法研究激素水平降低导致的失眠。负重游泳和PCPA模拟运动性失眠大鼠。
此外,郜红利等采用母乳鼠分离、多种焦虑刺激和注射PCPA造心肾不交大鼠失眠模型,动物表现为睡眠时间减少,血象水平降低,下丘脑-垂体-肾上腺轴紊乱。何博赛通过对Wistar大鼠连续5d腹腔注射50 mg/(kg.d)氢化可的松,再连续4 d腹腔注射300 mg/(kg.d)PCPA,动物出现弓腰无力、毛发少光泽、睡眠减少等现象,造成肝阴虚-失眠模型。林腊梅(52]建立肝血虚失眠模型,切除SD大鼠全肝的70%且恢复后,利用平台水环境法进行72 h REM 睡眠剥夺,动物呈现口唇、爪甲淡粉色,爪甲欠光滑,目光呆滞、反应迟钝等状态。黄攀攀等[53]对动物连续28 d皮下注射D-半乳糖60 mg/(kg.d),叠加8d腹腔注射咖啡因30 mg/(kg.d),再利用多平台水环境法进行 7 d 睡眠剥夺,造成大鼠的睡眠时间减少、心率加快、血压升高、耳温升高,成功建立老年阴虚失眠动物模型。朱洁等[54]采用夹尾和注射PCPA复合法造大鼠肝郁证失眠模型,连续20 d 每天夹尾45min,叠加连续2d腹腔注射400mg/(kg·d)PCPA。何林熹等[5s〕采用慢性束缚法复合夹尾15d造成肝郁化火证失眠大鼠模型。
文章来源:夏天吉,闫明珠,王智,靳苏维,刘新民,潘瑞乐,常琪.大小鼠失眠模型和评价方法研究进展.中国实验动物学报 2022 年6月第30 卷第3期
阅读原文:大小鼠失眠模型和评价方法研究进展.pdfhttps://www.gdlami.com/uploadfiles/2022/7/%E5%A4%A7%E5%B0%8F%E9%BC%A0%E5%A4%B1%E7%9C%A0%E6%A8%A1%E5%9E%8B%E5%92%8C%E8%AF%84%E4%BB%B7%E6%96%B9%E6%B3%95%E7%A0%94%E7%A9%B6%E8%BF%9B%E5%B1%95.pdf
相关阅读推荐:
失眠小鼠模型的建立|动物睡眠剥夺模型制备https://www.gempharmatech.com/activity/article/fbcd1eb6-64af-424d-9572-77fffcf1a793.html
失眠小鼠模型的建立原则https://www.gempharmatech.com/activity/article/43dc0e3e-d7d0-44d4-b269-aaf0130af436.html