相关研究报告显示,中国是世界上骨质疏松症(OP)患者最多的国家,约有9000万人罹患此病,其发病率与年龄息息相关。OP的危害主要为易发骨折、骨质疏松性骨折导致的残疾、心肺功能障碍等,极大地影响老年人生活质量。
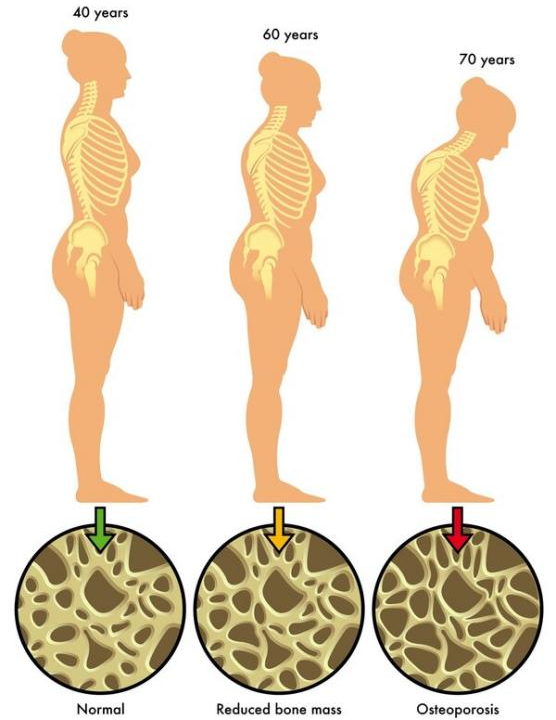
图1. 不同年龄阶段OP表型
骨质疏松症OP的分类和分型
OP发病受多重因素影响,包括遗传、激素、营养、年龄、生活习惯及免疫学等。临床常见的OP根据病因可分为原发性、继发性、特发性OP三类[1]。
1. 原发性OP
原发性OP是临床最常见的类型(约占80%),又分为Ⅰ型高转换型OP(以骨吸收增加为主,常见于绝经后女性)和Ⅱ型低转换型OP(以骨形成减少为主,常见于老年人)。
表1. Ⅰ型与Ⅱ型OP的特点

1. 继发性OP
继发性OP是指由于某些疾病或某些原因诱发的骨质疏松,根据发病原因可分为先天性OP、内分泌性OP、营养缺乏性OP、血液系统性OP、药物性OP等等。
2. 特发性OP
特发性OP包括:青少年OP、青壮年OP以及妊娠、哺乳期OP或骨量减少。
常见的OP模型构建方式
关于OP的研究(发病机制、药物筛选、防治手段等)都离不开动物模型的构建和应用[2]。由于OP发病机制较为复杂、药物作用机制与作用靶点不同,因此抗骨质疏松症药物药效学研究过程中动物模型的选择有所不同。
理想的OP模型至少需要符合以下几点[3]: 一是简便,即建模方法简单,周期短,建模过程具有较强的可控性和可操作性; 二是经济,即建模费用适中,可大批量应用; 三是相似性好,能较好地模拟OP发生和发展的过程。经过长期实践探索,OP 研究中模式动物种类繁多,造模方法可概括为诱导建模和基因工程建模两类。

图2. OP模型构建方式
诱导建模根据诱导原理和方式的不同可分为手术诱导(卵巢切除术、甲状旁腺切除、松果体切除等)、药物诱导(如维甲酸、糖皮质激素等)、饮食诱导(如低钙、磷、维生素D饮食等)、失用性诱导(如悬尾、固定等)等;基因工程动物主要包括基因敲除模型(全身性敲除、条件性敲除)、基因过表达模型以及腺病毒转染等方式构建的其他模型。
基于基因编辑技术构建自发OP模型品类型号
1、基于OPG/RANK/RANKL信号通路构建的基因编辑模型
人体骨组织处于不断重建中,成骨细胞骨形成与破骨细胞骨吸收之间的联系是骨代谢平衡的必要条件,而骨保护素(OPG)/核因子κβ受体活化因子(RANK)/核因子κβ受体活化因子配体(RANKL)信号通路是成骨细胞与破骨细胞之间通讯的重要桥梁[4]。
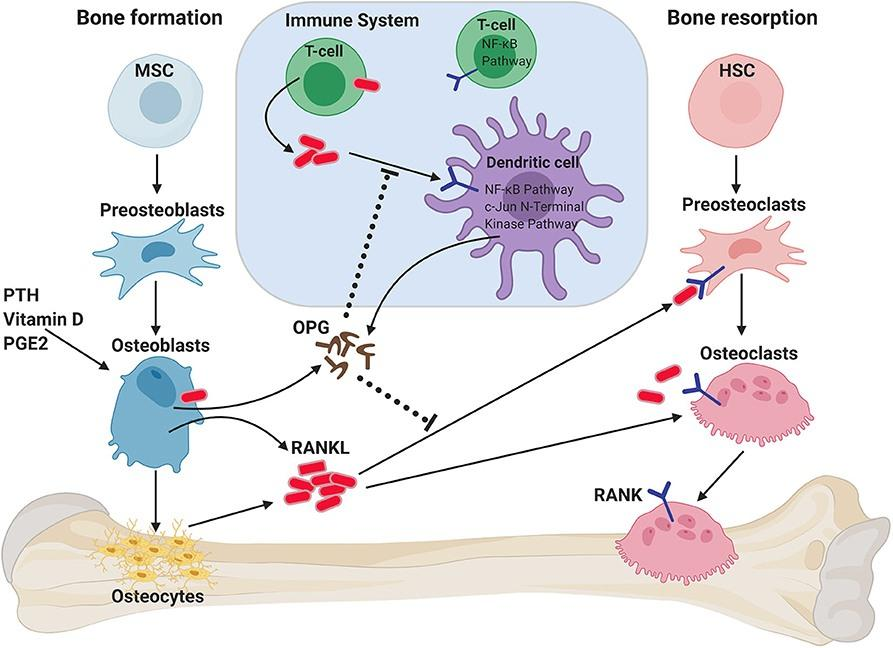
图3. OPG/RANK/RANKL在骨稳态中的作用
RANKL(TNFSF11)是TNF超家族成员,参与免疫调节及骨代谢(形成/吸收),是破骨细胞分化及成熟的重要激活因子。RANKL通过与RANK结合在调控破骨细胞的形成及其在骨重建中发挥重要作用。而OPG通过与RANKL结合,阻断RANK与RANKL结合,从而抑制骨吸收,维持骨代谢平衡[4-5]。因此,过表达RANKL或下调OPG水平可能会导致破骨细胞过度活化而出现OP。
OPG/RANK/RANKL信号系统除调节骨代谢平衡外,也参与细胞增殖、血管硬化、肿瘤骨转移、炎症和骨免疫等多种生理生化过程[6]。因此,靶向OPG、RANKL等靶点开发治疗骨质疏松及其他骨代谢疾病治疗药物具有重要意义。
表2. 相关模型推荐
品系编号 | 品系名称 | 品系类型 | 品系特点 |
Transgenic | 过表达人源RANKL基因,骨质疏松表现为骨小梁减少、骨小梁间连接性差。 | ||
T037319 | B6-hRANKL-mOPG | Transgenic & KO | 过表达人源RANKL基因并敲除鼠源OPG基因,骨质疏松表型较B6-hRANKL更严重。 |
KO | 研究表明OPG−/−小鼠表现出总骨密度降低,其特征是严重的小梁和皮质骨孔隙度,头骨顶骨明显变薄,骨折发生率高[7]。 | ||
CKO | 需配合CER工具鼠使用,实现OPG在特定组织器官的敲除。 |
注:Tnfrsf11b为opg的官方名
2、基于Wnt及BMP信号通路构建的基因编辑模型
在骨形成的过程中,最重要的便是Wnt及BMP信号通路。BMP(bone morphogenetic protein,骨形态发生蛋白)是转化生长因子-beta(TGF-β)超家族成员,广泛存在于人和动物的骨组织中,由成骨细胞产生,结合膜上I型或II型BMP受体,将信号转导至Smad家族核因子实现信号通路的活化,进而激活下游成骨细胞特异性转录因子runx2、osterix等并上调其表达[8]。Wnt是是F-跨膜卷曲蛋白受体家族(FZD)的配体,在成骨细胞中,通过与LRP-5/6结合,改变膜受体构象将信号传入胞内,进而激活β-catenin等下游蛋白,促进骨髓间质干细胞向成骨细胞分化并抑制其凋亡[9]。
通过对Wnt及BMP信号通路的进一步研究发现,硬骨素(SOST)是一种高度保守的主要由骨细胞分泌的糖蛋白,是骨形成的重要负调控因子[10-12]。过表达SOST将通过抑制Wnt和BMP信号通路来影响成骨细胞的分化和增殖,从而抑制骨形成。骨形成受到抑制造成的骨重塑平衡被破坏,将导致小鼠产生OP[12-14]。
目前,FDA批准的SOST单抗Romosozumab在Ⅰ型与Ⅱ型OP患者中都显示出较好的疗效,不仅能抑制骨吸收,更能促进新骨形成[15]。然而,目前Romosozumab仍存在在防治股骨骨折时效果不如预期,副作用较大的问题影响药物使用。因此,开发更安全、高效的SOST靶向药物也成了目前骨质疏松药物开发市场的重要目标。
表3. 相关模型推荐
品系编号 | 品系名称 | 品系类型 | 品系特点 |
Knockin(KI) | 鼠源SOST编码区原位替换为人源SOST相应序列,可应用于靶向SOST靶点的药物评价。 | ||
Transgenic(Tg) | 携带鼠源Dmp1启动子和人源SOST cDNA的转基因小鼠模型,该模型可自发骨质疏松症。 |
3、其他基因编辑模型
Klotho基因编码一种跨膜蛋白,其中含有多种成纤维细胞生长因子(FGH)受体,且是FGF23的复合受体。敲除Klotho基因获得的klotho-/-小鼠是一种快速老化的动物模型,其成骨细胞的数量减少,骨矿化作用受阻,能成功模拟老年性OP的特点[16]。
老化星形胶质细胞特异性诱导物(OASIS)在成骨细胞中显著表达。敲除该基因获得的oasis-/- 小鼠骨形成受抑制,骨折风险增加,有望成为一种新型OP模型,用于药物治疗骨量减少的新药开发[17]。
除此之外,还有很多与骨质疏松相关的基因,通过构建基因敲除或过表达模型等,可以更好研究基因功能和致病机制,为疾病的治疗和预防提供有利的依据。
参考文献:
1. 李险峰. 骨质疏松症的分类和分型. 中国全科医学. 2005, (16).
2. 薛丽香, 张凤珠, 孙瑞娟, 等.我国疾病动物模型的研究现状和展望.中国科学: 生命科学,2014,44( 9) : 851-861.
3. 孙凯, 魏戌, 朱立国, 等. 病证结合模式下骨质疏松症实验动物模型的研究进展. 中国骨质疏松杂志, 2019, 25 ( 9) :1340-1344.
4. 李小娜. OPG/RANK/RANKL信号通路研究进展.河南医学研究, 2014.
5. Rinotas, Vagelis, et al. Novel genetic models of osteoporosis by overexpression of human RANKL in transgenic mice. Journal of Bone and Mineral Research 29.5 (2014): 1158-1169.
6. 屈晓龙, 蒋涛. OPG-RANKL-RANK信号系统与骨质疏松治疗的研究进展. 生命科学. 2018, 30(07).
7. Bucay, Nathan, et al. Osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification. Genes & development 12.9 (1998): 1260-1268.
8. Winkler DG, Sutherland MK, Geoghegan JC, et al. Osteocyte control of bone formation via sclerostin, a novel BMP antagonist [J]. The EMBO Journal Vol. 22 No. 23 pp. 6267-6276, 2003.
9. Baron R, Rawadi G. Wnt signaling and the regulation of bone mass. Curr Osteoporos Rep. 2007 Jun;5(2):73-80.
10. Balemans W, Ebeling M, Patel N, et al. Increased bone density in sclerosteosis is due to the deficiency of a novel secreted protein (SOST). Human Molecular Genetics 10.5(2001):537-543.
11. Brunkow ME, Gardner JC, Ness JV, et al. Bone Dysplasia Sclerosteosis Results from Loss of the SOST Gene Product, a Novel Cystine Knot–Containing Protein. The American Journal of Human Genetics 68.3(2001):0-589.
12. Wu MG, Chen GQ and Li YP. TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease. Bone Research 4(2016):16009.