炎症性肠病(Inflammatory Bowel Disease,IBD)是一类病因尚不明确的慢性、特发性消化道疑难杂症,具有无法治愈、病程反复、治疗困难、好发于青壮年的特点[2],主要包括溃疡性结肠炎(Ulcerative Colitis, UC)和克罗恩病(Crohn' s Disease, CD)两种疾病表型,临床上,IBD病人普遍存在腹痛、腹泻、低烧、营养不良等症状。其中,UC病人会普遍出现脓血便和局限于结肠黏膜上层的炎症、溃疡等症状[3];而CD病人可在整个消化道范围内出现慢性炎症反应,表现出肠腔狭窄、瘘管、肠梗阻等疾病表现。此外,如果IBD病人不能实现有效的疾病控制,肠道癌变的风险将随着患病年限的推移而快速上升,最终将诱发小肠和结肠癌变[4]。

图1.CD和UC的区别
目前,针对IBD的致病机制仍然没有统一的结论,普遍认为遗传、免疫、环境、微生物是诱发IBD发病的四大因素。
1、IBD发病存在基因与免疫系统以及肠道上皮之间复杂的相互作用,截至目前为止,已发现约250个基因位点与IBD发病有关等[5];
2、免疫系统的调节失衡与慢性炎症反应也有直接联系,一般认为,免疫系统的激活起始于结肠上皮的破损和外界抗原的入侵,引起固有免疫和适应性免疫的激活,进而形成不可逆的慢性炎症;
3、在环境方面,如空气污染、吸烟、消化道感染及日常饮食结构等都会对IBD的发病产生直接或间接的影响[6];
4、肠道菌群是维护结肠上皮微环境稳态的重要因素,目前已有大量文献表明肠道菌群的紊乱会加速IBD的疾病进展。
总而言之,IBD发病并不是单一因素作用的结果,而是多种因素共同作用,形成一个系统而复杂的IBD作用机制网络,这也为IBD发病机制的研究及临床治疗带来了巨大挑战。
IBD作为一种慢性、反复性的肠道疾病,治疗一般是长期的,治疗目标主要是改善症状,同时也要维持临床缓解和内镜下黏膜愈合,防止并发症,改善患者生活治疗。临床上针对IBD的治疗主要包括药物疗法和手术疗法两种,传统的药物治疗非甾体类抗炎药物、皮质类固醇和免疫抑制剂,对早期IBD患者有一定缓解效果,但这类药物多为广谱类药物,多存在明显的副作用,患者对药物的耐受性较差。新兴疗法如生物制剂TNF-α单抗等的广泛应用有效缓解了患者疾病症状,降低患者手术治疗概率。
无论是研究疾病机制还是新药研发,早期研究往往都离不开动物模型。集萃药康已成功构建了多种IBD动物模型,同时可根据药物的作用机制匹配合适的动物模型。
① DSS诱导模型—表型上与UC相似,可作为急性/慢性肠炎模型
② DNBS诱导模型—表型上与CD相似,可作为急性肠炎模型
③ IL-10 KO模型—自发肠炎模型,发病率、发病周期与环境相关
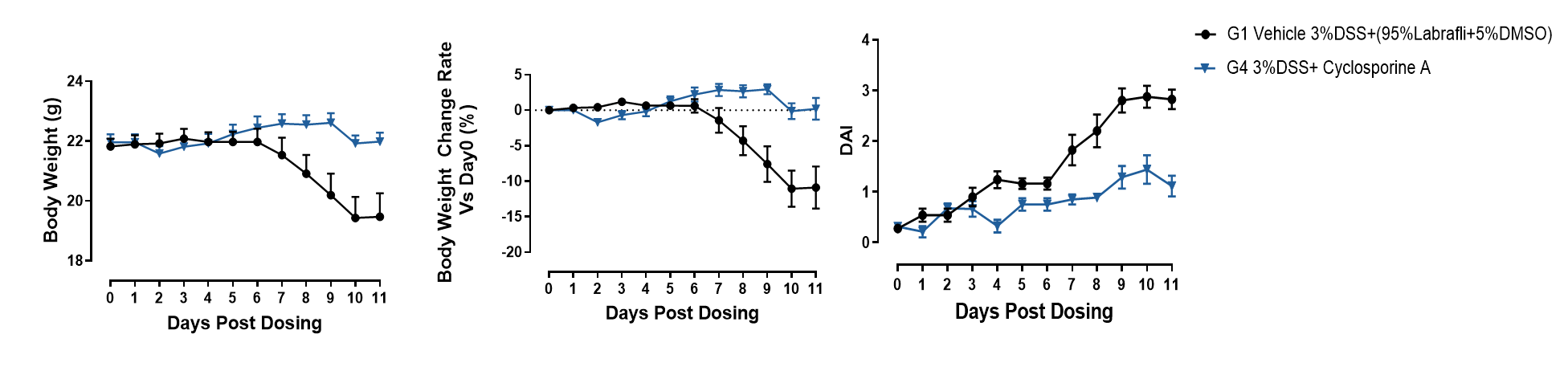
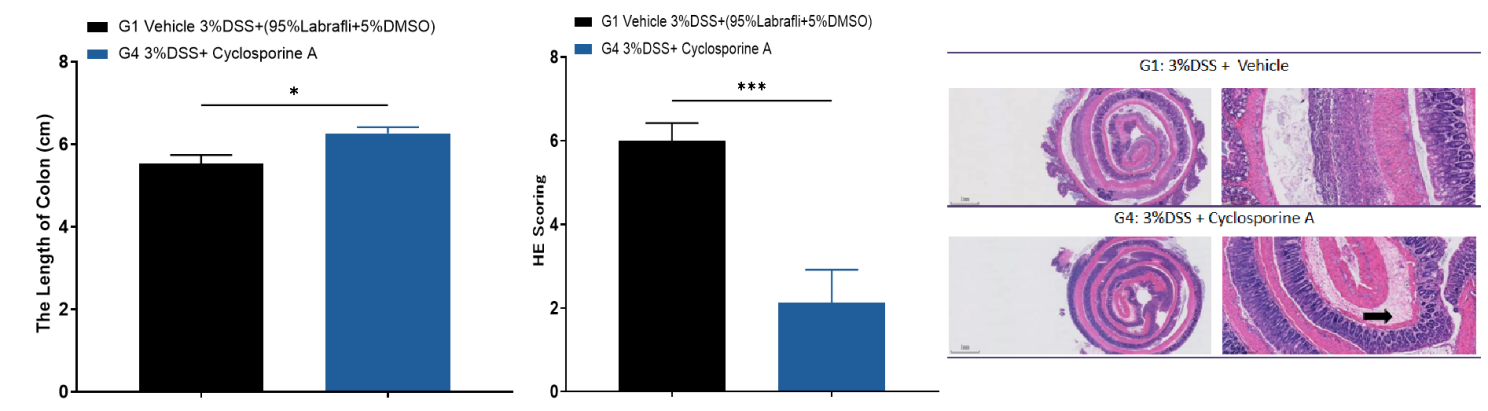
使用环孢霉素A可有效缓解DSS诱导的UC疾病表型
参考文献
[1]. Kaplan, G.G. and J.W. Windsor, The four epidemiological stages in the global evolution of inflammatory bowel disease. Nature reviews. Gastroenterology & hepatology, 2021. 18(1): p. 56-66.
[2]. Kaplan, G.G. and S.C. Ng, Understanding and Preventing the Global Increase of Inflammatory Bowel Disease. Gastroenterology, 2017. 152(2): p. 313-321.e2.
[3]. Ungaro, R., et al., Ulcerative colitis. Lancet, 2017. 389: p. 1756-1770.
[4]. Torres, J., et al., Crohn's disease. The Lancet, 2017. 389: p. 1741-1755.
[5]. Khor, B., A. Gardet and R.J. Xavier, Genetics and pathogenesis of inflammatory bowel disease. Nature, 2011. 474(7351): p. 307-317.
[6]. Ananthakrishnan, A.N., Epidemiology and risk factors for IBD. NATURE REVIEWS GASTROENTEROLOGY & HEPATOLOGY, 2015. 12(4): p. 205-217.