2022年8月,暨南大学药学院张冬梅教授团队在Journal of Clinical Investment (IF=19)在线发表了题为“Targeting FAPα-expressing hepatic stellate cells overcomes resistance to anti-angiogenics in colorectal cancer liver metastasis models”的文章。

结直肠癌肝转移CRCLM治疗研究背景:
结直肠癌(CRC)是世界上第三常见和第二致命的恶性肿瘤。结直肠癌肝转移(CRCLM)占疾病死亡率的70%以上。血管生成抑制剂贝伐单抗常用于CRCLM的治疗。由于内源性和获得性耐药经常发生,导致治疗失败和癌症复发。肝星状细胞(HSCss被认为是肝脏特异的周细胞,在CRCLM的病理过程中起着至关重要的作用,成纤维细胞激活蛋白α(FAPα)是一种II型完整膜丝氨酸蛋白酶,选择性地表达于肿瘤周细胞或肿瘤相关成纤维细胞(CAF)。
结直肠癌肝转移(CRCLM)三种生长模式:
CRCLM主要包括三种不同的组织病理学生长模式(HGP):促结缔组织增生型(DHGP)、推进型(PHGP)和替换型(RHGP)。这些生长模式具有不同的组织病理学特征,并利用不同的方式获得血管供应。DHGP和PHGP血管生成是肿瘤的主要供血方式。对于RHGP,肿瘤细胞渗入肝实质的肝板并劫持原有的肝窦血管,这被称为血管选定。血管选定被认为是CRCLM抵抗血管生成治疗的重要机制。但其分子机制尚不清楚。
研究所用动物模型小鼠型号品类:
该研究采用集萃药康B6/JGpt-Fapem1Cflox/Gpt及B6/JGpt-H11em1Cin(GFAP-iCre)/Gpt小鼠,报道了利用Fap条件性敲除小鼠模型,通过多个技术手段发现FAPα通过激活CXCR2,诱导HSCs分泌CXCL5,促进肿瘤细胞皮质细胞转化和髓样抑制细胞募集,从而促进血管选定。靶向FAPα+HSCs可有效阻断增选的肝窦血管,克服贝伐单抗产生的耐药。
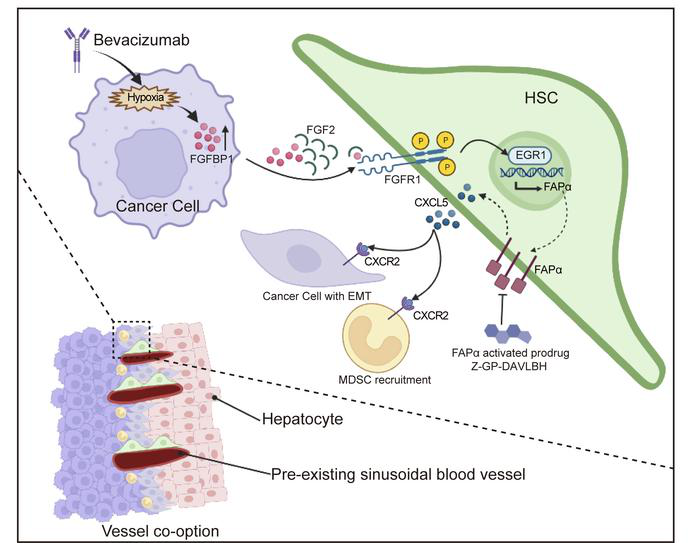
结直肠癌肝转移CRCLM治疗研究五大发现:
1. 对贝伐单抗耐药的CRCLM移植瘤可能与血管选定的肝星状细胞FAPα的表达有关
对贝伐单抗敏感的HCT116 CRCLM移植瘤(28例)给予贝伐单抗(10 mg/kg)处理42d,建立获得性耐药模型,对贝伐单抗固有耐药的HT-29 CRCLM异种移植瘤(29例)用贝伐单抗(10 mg/kg)治疗12d,建立固有性耐药模型。通过检测CRCLM移植瘤中的HGP,发现贝伐单抗耐药组肿瘤中的HGP主要是RHGP。免疫荧光进一步显示耐药组中共选窦状血管的数量较多。进一步研究其窦状血管的变化特征,结果发现对贝伐单抗耐药的CRCLM移植瘤可能与血管选定的肝星状细胞FAPα的表达有关。

图1 贝伐单抗治疗诱导CRCLM异种移植HSCs中窦状血管增多可能与FAPα的表达有关
2、Fapα诱导HSCs分泌CXCL5促进血管选定
研究者将MC38 cell(小鼠结肠癌细胞)直接注入Fap野生型小鼠(Fapf1/fl)或造血干细胞特异性条件性Fap基因敲除小鼠(Fap△Gfap),建立固有性耐药的Fap△Gfap模型。通过标记HGPs、CK18、CD8+T细胞等,发现Fapf1/fl小鼠的MC38 CRCLM移植物主要由RHGP和大量的共选的窦状血管组成,而Fap△Gfap小鼠的移植物数量明显减少。与Fapf1/fl小鼠相比,在Fap△Gfap小鼠中建立的MC38 CRCLM同种异体移植显著抑制了Gr-1与髓样抑制细胞的募集,CD8+T细胞的频率显著增加。

图2 条件性敲除HSCs中的Fapα减弱血管选定
为了进一步探究FAPα在肝星状细胞调节血管选定中的作用机制,研究者建立了稳定过表达FAPα的人肝星状细胞系LX2FAP和阴性对照细胞(LX2Vector),通过Lx2细胞分泌因子差异表达基因热图、RT-qPCR、ELISA等方法分析Lx2细胞分泌因子的相关基因的表达差异,结果发现FAPα通过激活CXCR2,诱导HSCs分泌CXCL5,促进肿瘤细胞间质转化和髓样抑制细胞募集,从而促进血管选定。
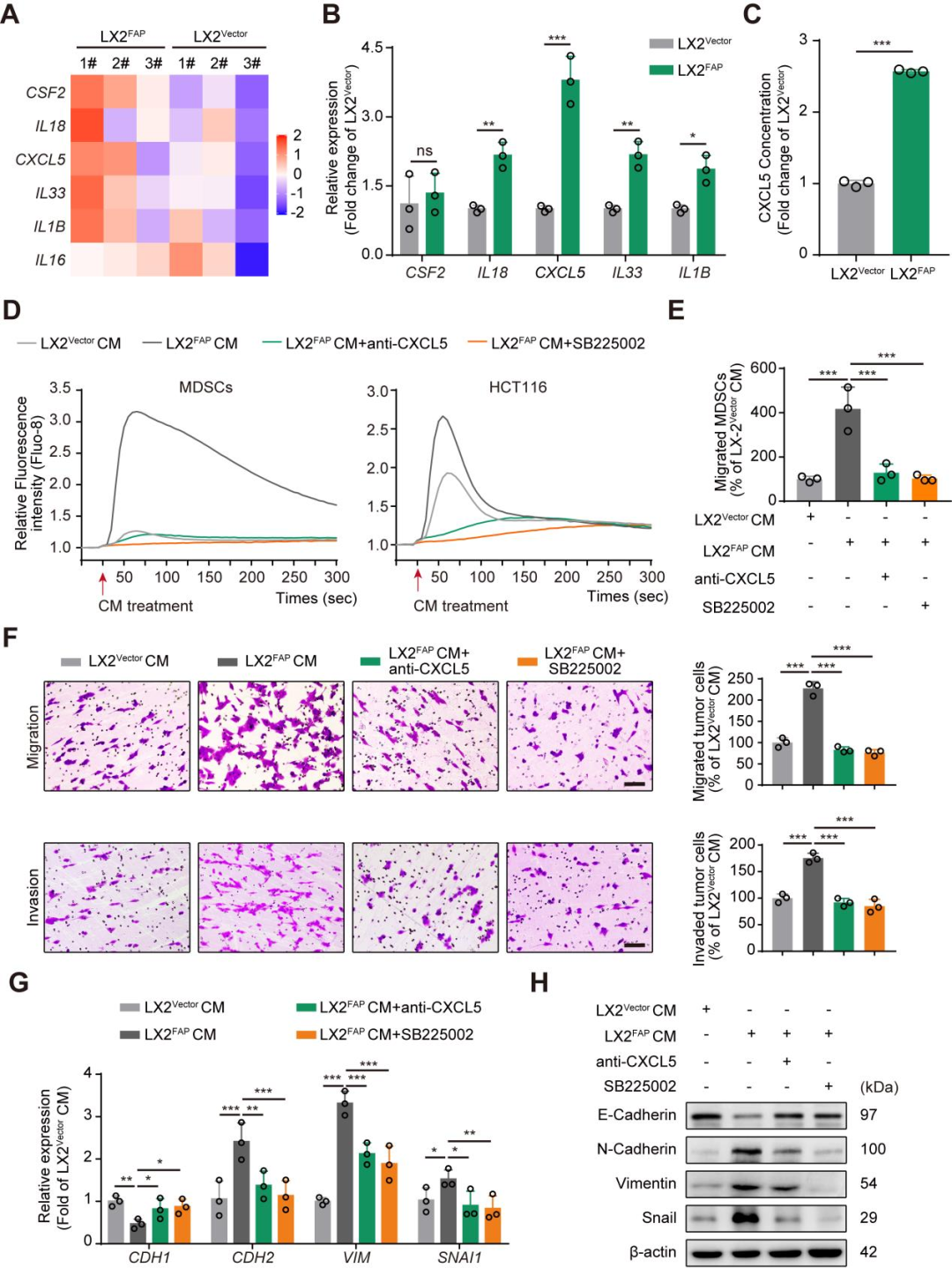
图3 FAPα通过激活CXCR2诱导HSCs分泌CXCL5以促进髓样抑制细胞的募集和肿瘤细胞间质转化
3、肿瘤细胞来源的FGFFBP1诱导HSCs表达FAPα促进血管选定
研究者运用蛋白质组学方法分析了贝伐单抗敏感和耐药的HCT116 CRCLM异种移植瘤,结果发现,17个上调的蛋白质,RT-qPCR分析证实FGFBP1是其中最显著上升的基因。含有FGFBP1的慢病毒载体或FGFBP1序列分别导入低表达的HCT116细胞,构建HCT116 Vector和高表达FGFBP1的细胞(HCT116 FGFBP1),HT-29shNC细胞和FGFBP1敲除的HT-29sh FGFBP1细胞作为阴性对照,结果在HCT116 FGFBP1和HT-29shNC CRCLM异种移植瘤的肝窦血管中其FAPα的表达水平分别高于HCT116 Vector和HT-29sh FGFBP1 CRCLM异种移植瘤,证实肿瘤细胞来源的FGFFBP1诱导HSCs中FAPα的表达,并促进血管选定。
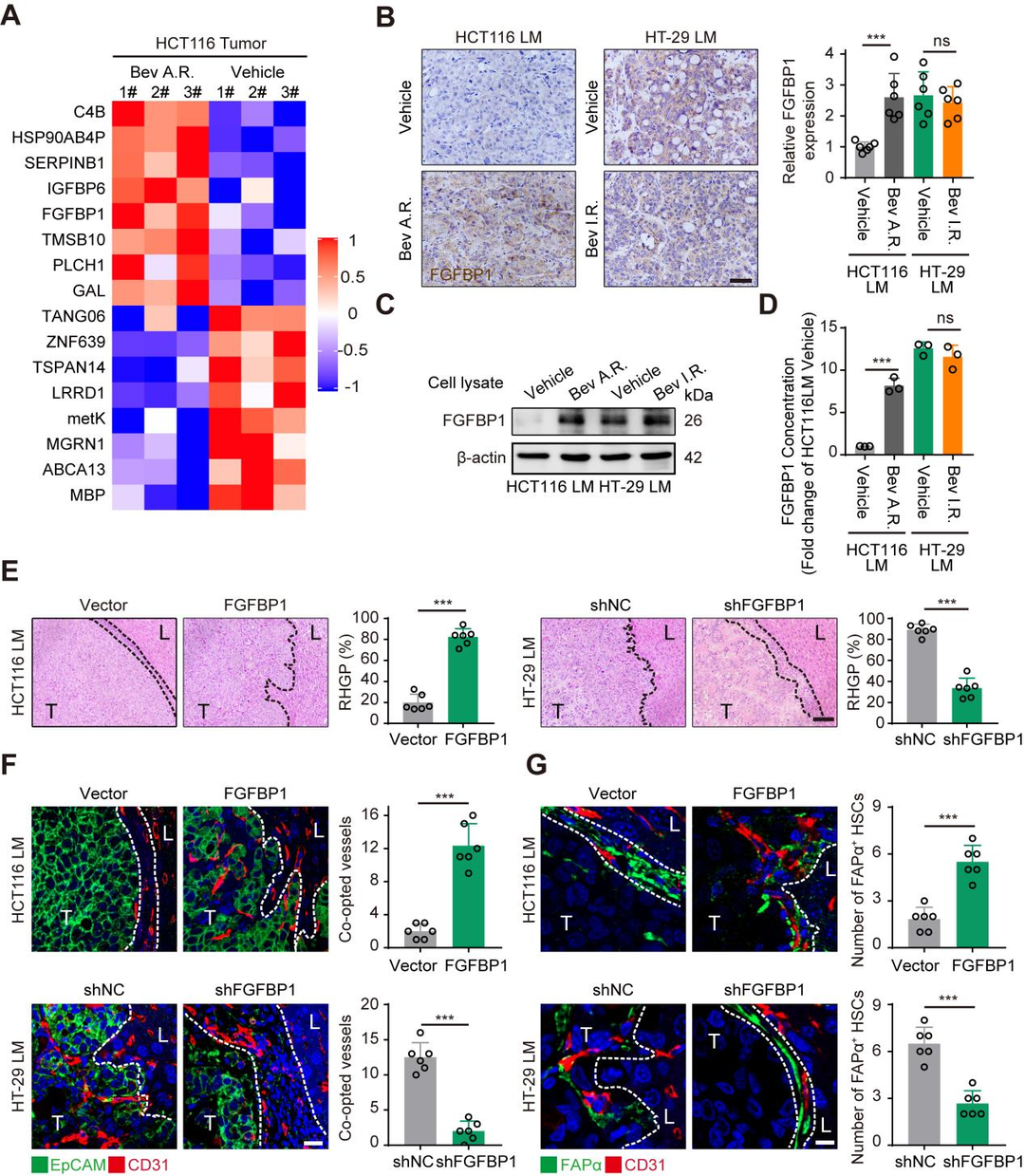
图4 肿瘤细胞来源的FGFFBP1诱导HSCs表达FAPα促进血管选定
4. 肿瘤细胞来源的FGFBP1通过FGF2-FGFR1-ERK1/2-EGR1轴诱导HSCs表达FAPα
研究者通过Western blotting及免疫荧光检测分析FGFR1、p-FGFR1、ERK1/2、p-ERK1/2、Egr1和FAPα等的表达,结果发现LX-2细胞中FGF2和FGFR1的表达水平高于其他组FGFs和FGFRs(图5A、B);贝伐单抗耐药的HCT116和HT-29CRCLM移植瘤中,FGF2和FGFR1在FAPα+HSCs中有较高表达。qPCR分析表明,经HCT116 FGFBP1或HT14 29shNC细胞条件培养液处理的LX-2细胞的Egr1与FAP启动子的结合显著高于经HCT116 Vector或HT-29 shFGFBP1细胞条件培养液处理的LX-2细胞(图5F)。这些结果表明,肿瘤细胞来源的FGFFBP1通过FGF2-FGFR1ERK1/2-EGR1轴诱导HSCs中FAPα的表达。
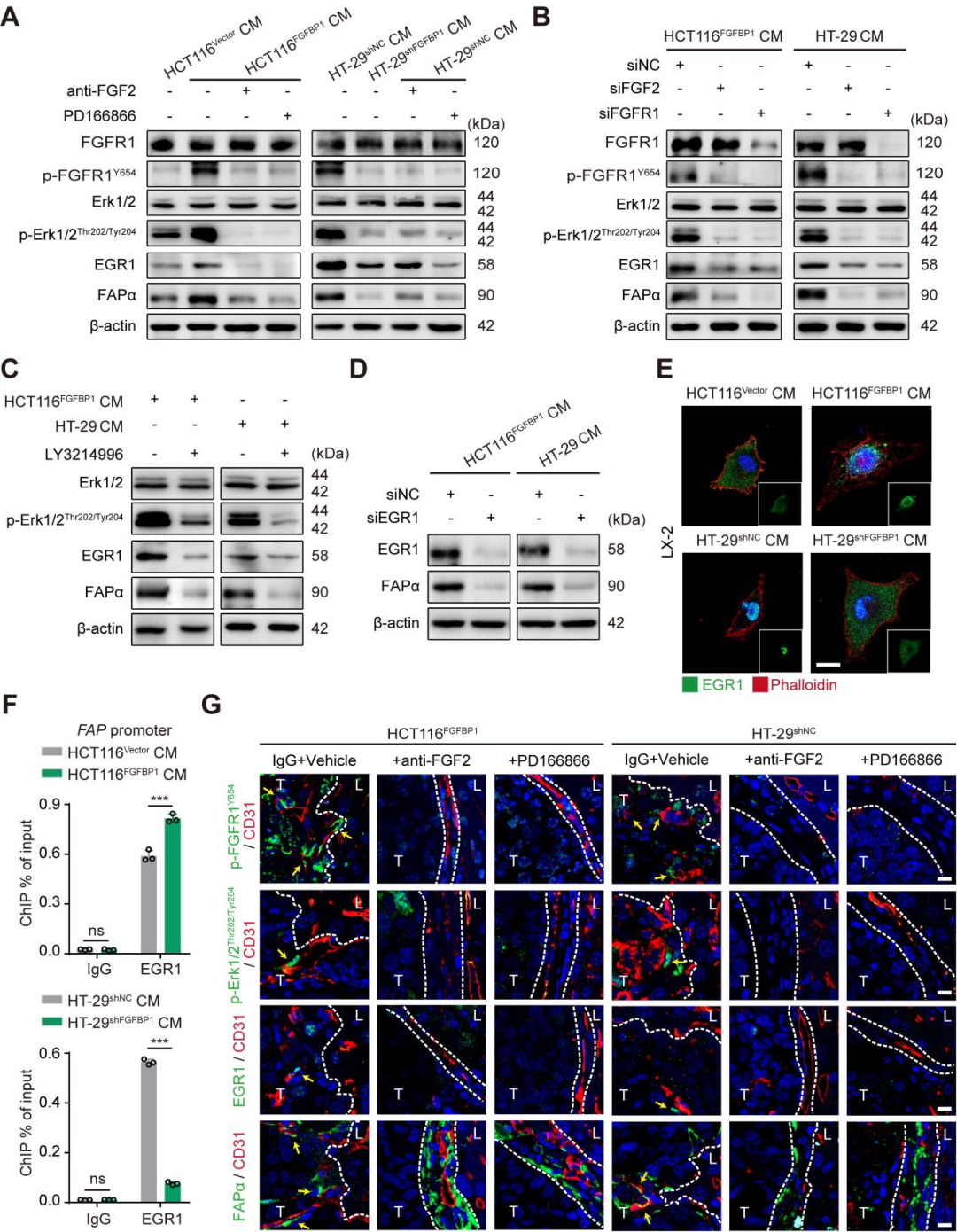
图5 肿瘤细胞来源的FGFFBP1通过FGF2-FGFR1-ERK1/2-EGR1轴诱导HSCs表达FAPα
5、Z-GP-DAVLBH可选择性诱导FAPα+ HSCs凋亡破坏血管选定克服贝伐单抗耐药
研究者利用实验室合成的FAPα激活的前药Z-GP-DAVLBH分别治疗HCT116 CRCLM移植瘤及HC-29 CRCLM移植瘤,结果发现Z-GP-DAVLBH治疗后其肿瘤面积减少,CRCLM移植瘤-肝脏界面的H&E染色表明肝窦血管被破坏而导致肝脏-肿瘤界面出血,选定血管数量减少了18条,同时延长了HCT116 CRCLM移植瘤及HC-29 CRCLM移植瘤小鼠的总体存活时间。以上结果证实Z-gp-DAVLBH可选择性诱导FAPα+HSCs的凋亡,破坏共选的肝窦血管,克服血管选定介导的贝伐单抗治疗耐药。

图6 贝伐单抗诱导CRCLM患者的血管选定以调节治疗耐药
研究结论
贝伐珠单抗通过成纤维细胞生长因子结合蛋白1 (FGFBP1)-FGF2-FGFR1-ERK1/2-EGR1轴诱导HSCs中FAPα的表达,而FAPα促进HSCs中CXCL5的分泌,从而激活CXCR2增强骨髓源性抑制细胞(MDSC)浸润和肿瘤细胞EMT,进而促进血管选定。此外,用FAPα激活的前药Z-GP-DAVLBH靶向FAPα+HSCs可有效克服血管选定介导的CRCLM对抗血管生成治疗的耐药性。