10月17日,复宏汉霖(2696.HK)宣布,其自主开发的HLX60(创新型抗GARP单抗)用于治疗实体瘤和淋巴瘤的临床试验申请获国家药品监督管理局批准。HLX60是国内首个获批临床的靶向GARP的单抗产品,有望成为First-in-class抗GARP单抗(点击查看原文)。此药物的非临床研究采用了集萃药康的B6-hLRRC32(GARP,品系编号T015882)小鼠,用于该药物的药效研究和非临床安全性评估。
GARP-糖蛋白A重复优势蛋白(Glycoprotein A repetitions predominant)表达于活化的调节性T细胞(Tregs)、血小板及部分肿瘤细胞表面,通过与潜伏转化生长因子-β1(LTGF-β1)结合,将LTGF-β1富集在细胞表面,在肿瘤微环境中释放出活性TGF-β1,从而抑制肿瘤免疫应答。
HLX60为复宏汉霖自主研发的靶向GARP的创新型单抗,其可通过特异性结合GARP,阻断GARP介导的TGF-β1的释放,逆转TME中的免疫抑制效应,提高抗肿瘤免疫应答。此外,HLX60可以通过抗体依赖细胞介导的细胞毒作用(ADCC)清除GARP阳性肿瘤细胞和Tregs等免疫抑制性细胞,从而发挥抗肿瘤作用。临床前研究结果显示,HLX60可以抑制肿瘤生长且安全性良好。同时,该药与抗PD-1单抗H药汉斯状®(斯鲁利单抗)联用具有协同抗肿瘤效应。值得一提的是,HLX60项目从确定分子到拿到IND批件仅用时约16个月,项目得以快速推进到临床阶段。近期,HLX60联合H药已于澳大利亚获批开展I期临床研究,拟用于晚期或转移性实体瘤的治疗。
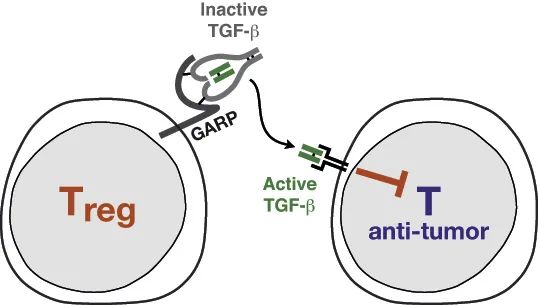
图1.GARP蛋白调节Treg细胞的机制
(图片来源:https://www.deduveinstitute.be/tregs-and-tgfb)
B6-hLRRC32(GARP)小鼠可作为GARP抗体药物筛选的动物模型
集萃药康利用CRISPR/Cas9技术和胚胎注射技术,将鼠源GARP基因替换为了人源GARP片段,构建了GARP人源化小鼠,为GARP抗体药物筛选提供动物模型。
检测到Wildtype雄性和雌性小鼠脾脏中mGARP阳性T细胞占CD4+CD25+ T细胞比例分别为24.08%和17.75%,Homozygote B6-hLRRC32雄性和雌性小鼠脾脏中hGARP阳性T细胞占CD4+CD25+ T细胞比例分别为21.06%和22.43%。表明B6-hLRRC32小鼠hGARP阳性T细胞比例与Wildtype小鼠mGARP阳性T细胞比例相当。
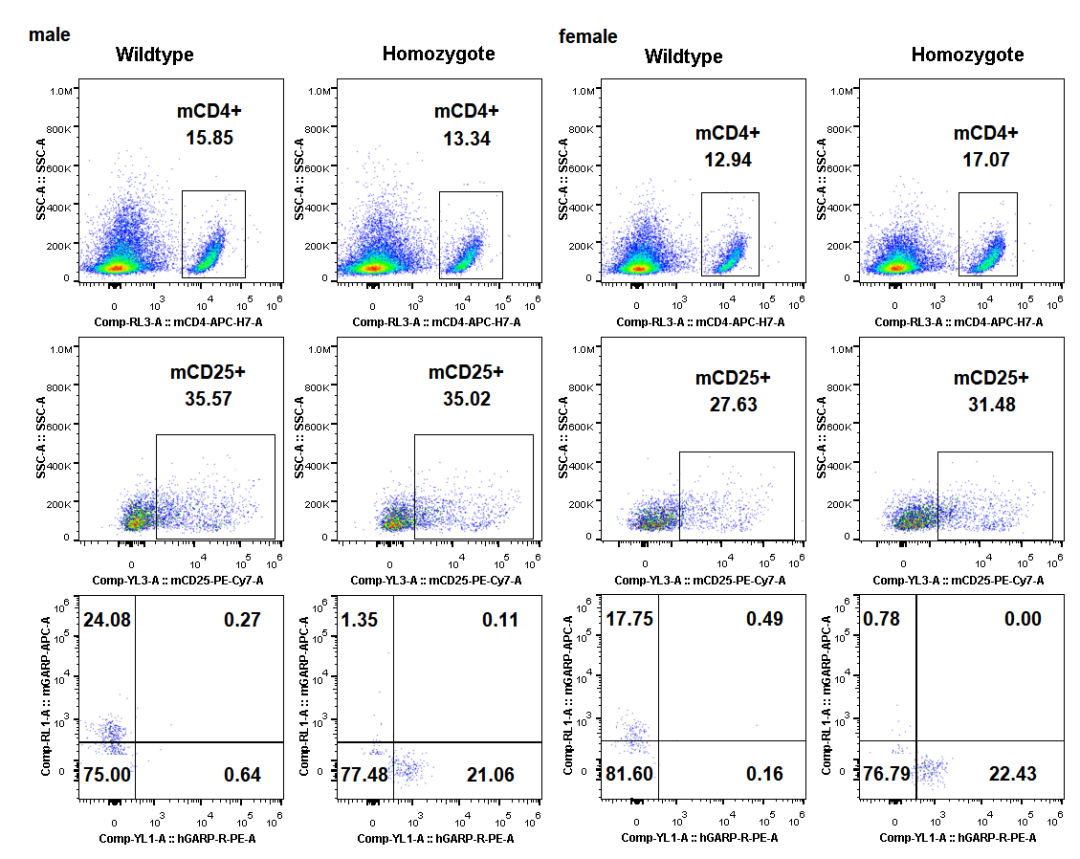
图2.流式检测B6-hLRRC32小鼠脾脏CD4+CD25+T细胞hGARP表达
人源化模型在大分子药物非临床研究中的应用
选择合适的动物种属进行非临床安全性评价,可以预测药物临床安全性风险。对于大分子药物研发,ICHS6(R1)《生物制品非临床安全性评价》指南对生物制品非临床安全性评价的动物种属选择给出建议:当无相关种属时,应该考虑使用表达人源受体的相关转基因动物或者使用同源蛋白进行药物安全性评价。如果药物与转基因动物人源受体相互作用的生理结果与人体的预期生理结果相似,使用转基因小鼠进行安全性评价是最佳选择。
结合上述指南和非临床试验经验,在存在靶点同源性差异和需要具有一定疾病表征时,在动物模型的选择上可以依据验证目标进行选择,这种情况下转基因小鼠具有一定的优势,包括进行人源化改造或基因编辑建立疾病模型等。复宏汉霖HLX60成功获得IND批准,表明了B6-hLRRC32(GARP)小鼠可以用于临床前抗GARP抗体药物药效和安全性评价。
n
集萃药康于2021年7月启动“药筛鼠”项目,计划构建800+药物靶点基因编辑小鼠品系和疾病研究小鼠模型,涵盖肿瘤、代谢、免疫、神经系统、心血管疾病等领域,前瞻性地为药物研发产业铺路。
关于复宏汉霖
复宏汉霖(2696.HK)是一家国际化的创新生物制药公司,致力于为全球患者提供可负担的高品质生物药,产品覆盖肿瘤、自身免疫疾病、眼科疾病等领域,已在中国上市5款产品,在国际上市1款产品,15项适应症获批,5个上市注册申请获得中国药监局受理。自2010年成立以来,复宏汉霖已建成一体化生物制药平台,高效及创新的自主核心能力贯穿研发、生产及商业运营全产业链。公司已建立完善高效的全球创新中心,按照国际药品生产质量管理规范(GMP)标准进行生产和质量管控,不断夯实一体化综合生产平台,其中,上海徐汇基地已获得中国和欧盟GMP认证,松江基地(一)也已获得中国GMP认证。
复宏汉霖前瞻性布局了一个多元化、高质量的产品管线,涵盖20多种创新单克隆抗体,并全面推进基于自有抗PD-1单抗H药汉斯状®的肿瘤免疫联合疗法。继国内首个生物类似药汉利康®(利妥昔单抗)、中国首个自主研发的中欧双批单抗药物汉曲优®(曲妥珠单抗,欧洲商品名:Zercepac®,澳大利亚商品名:Tuzucip®和Trastucip®)、汉达远®(阿达木单抗)和汉贝泰®(贝伐珠单抗)相继获批上市,创新产品汉斯状®(斯鲁利单抗)已获批用于治疗微卫星高度不稳定(MSI-H)实体瘤,其鳞状非小细胞肺癌、广泛期小细胞肺癌和食管鳞状细胞癌3项适应症的上市注册申请也正在审评中。公司亦同步就13个产品、11个免疫联合治疗方案在全球范围内开展20多项临床试验,对外授权全面覆盖欧美主流生物药市场和众多新兴市场。