2023年6月23日,四川大学高会乐课题组和成果课题组在Research(IF=11.036)期刊上在线发表了题为“Pathological BBB Crossing Melanin-Like Nanoparticles as Metal-Ion Chelators and Neuroinflammation Regulators against Alzheimer’s Disease”的论文。该研究使用了来自集萃药康自主产权阿尔茨海默症(Alzheimer’s disease, AD)小鼠模型FAD4T(C57BL/6JGpt-Tg(Thy-APP/Thy-PSEN1)5/Gpt,T053302)进行体内试验,结合免疫荧光分析、动物行为学实验及体内转录组分析等多个技术手段,展示了直接利用纳米材料PDA@K的固有特性作为AD治疗方法的优势,拓宽了纳米材料在AD疗法中的应用场景。

AD的发病机制被认为是多种复杂机制相互促进的结果,氧化应激作为神经元损伤的重要诱发因素,通过上调淀粉样前体蛋白 (APP)表达和增加分泌酶活性导致更多Aβ积累;反过来,Aβ的异常聚集进一步表现出其神经毒性并引发促炎反应。除此之外,AD患者脑中金属离子的不平衡也促进了AD的发展,金属离子如Cu2+和Zn2+,由于与Aβ的N端有高亲和力,导致Aβ斑块沉积,加速神经毒性;并且小胶质细胞的功能异常与Aβ沉积相互作用,共同促进了AD病程的加重。因此基于AD发展的复杂病因,研究人员设计了新型黑色素样金属离子螯合剂和神经炎症调节剂(melanin-like metal ion chelators and neuroinflammation regulators,PDA@K)用于AD治疗,通过金属螯合和活性氧(reactive oxygen species,ROS)清除来共同减少Aβ沉积并使功能失调的小胶质细胞正常化(图1)。随后,研究人员利用体外试验证明了其有效靶向Aβ、血脑屏障渗透性高和清除ROS的能力,具有良好的生物相容性;并且这种多功能策略在FAD4T转基因小鼠中显示出有效的小胶质细胞调节和神经保护作用,改善了疾病模型小鼠的记忆和认知障碍。
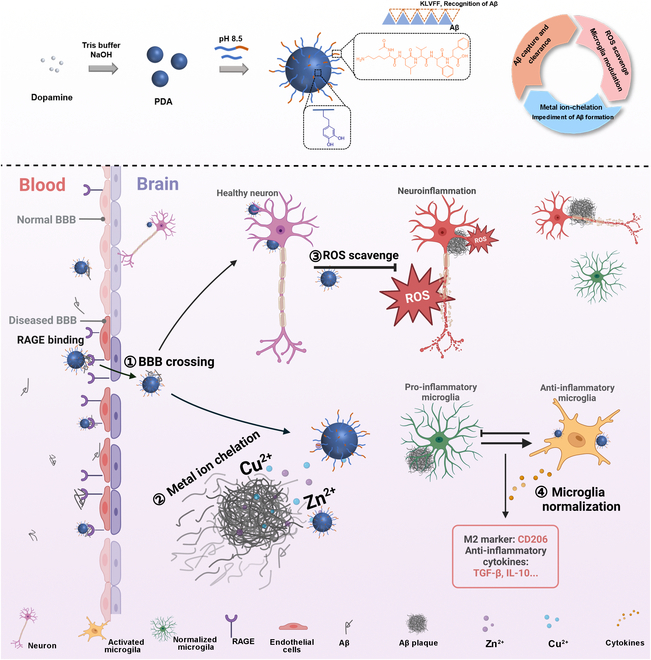
图1. PDA@K策略示意图
集萃药康将携带Swedish、Indiana突变的人源APP基因和携带M146L、L286V突变的人源PSEN1转入小鼠基因组,构建了FAD4T小鼠模型。相较于其他常用的转基因AD小鼠模型,FAD4T小鼠更早的表现出淀粉样蛋白沉积(1.5月龄)和小胶质细胞激活(1.5月龄),并伴有明显的记忆缺陷(5月龄),证明了在这种新模型中评估Nanoparticles(NPs)治疗效果的适用性和可靠性。FAD4T小鼠体内试验结果表明,经过的尾静脉注射给予NPs(3天一次,共7次)后,在水迷宫试验中,对照组FAD4T小鼠(5% glucose-injected)在4天的训练和probe test中表现出明显的学习和记忆缺陷,而PDA@K治疗的FAD4T小鼠表现出空间学习和记忆的改善,具体表现为到达目标平台的时间缩短和穿越平台的次数增加;在筑巢试验(nest-building test)中,治疗组FAD4T小鼠也表现出筑巢行为的改善(图2)。

图2. NPs治疗FAD4T转基因小鼠的行为评价
行为试验结束后,科研人员收集小鼠组织进行进一步分析。流式细胞检测和荧光染色的结果显示,FAD4T小鼠脑内ROS水平显著高于Wild type(WT)小鼠,而NPs治疗组,尤其是PDA@K组ROS水平显著降低。为了探讨NPs对Aβ沉积的影响,科研人员采用Aβ免疫组织化学和免疫荧光染色检测淀粉样斑块的数量。结果显示,FAD4T小鼠的皮层和海马中存在丰富的Aβ斑块,但经治疗后,Aβ斑块的数量和大小均明显减少,PDA@K treated组的Aβ斑块几乎不可见,接近WT水平。此外,PDA@K处理后,FAD4T转基因小鼠脑中M1型小胶质细胞(CD86+)表达下调,M2型小胶质细胞(CD206+)表达上调。同时,促炎细胞因子(TNF-α和IL-6)的分泌减少和抑炎细胞因子(TGF-β和IL-10)的表达增加也证实了对激活后小胶质细胞的调控作用。海马的尼氏染色和H&E染色结果则表明FAD4T小鼠中出现明显的核皱缩和神经元损伤,相比之下,NPs处理,特别是PDA@K治疗,显著减轻了神经细胞的损伤。同时,PDA@K处理组小鼠脑中的免疫应答通路蛋白如NF-κB p65和IKB-α表达下调证明了PDA@K治疗对于ROS清除、小胶质细胞极化和神经保护的调控作用(图3)。
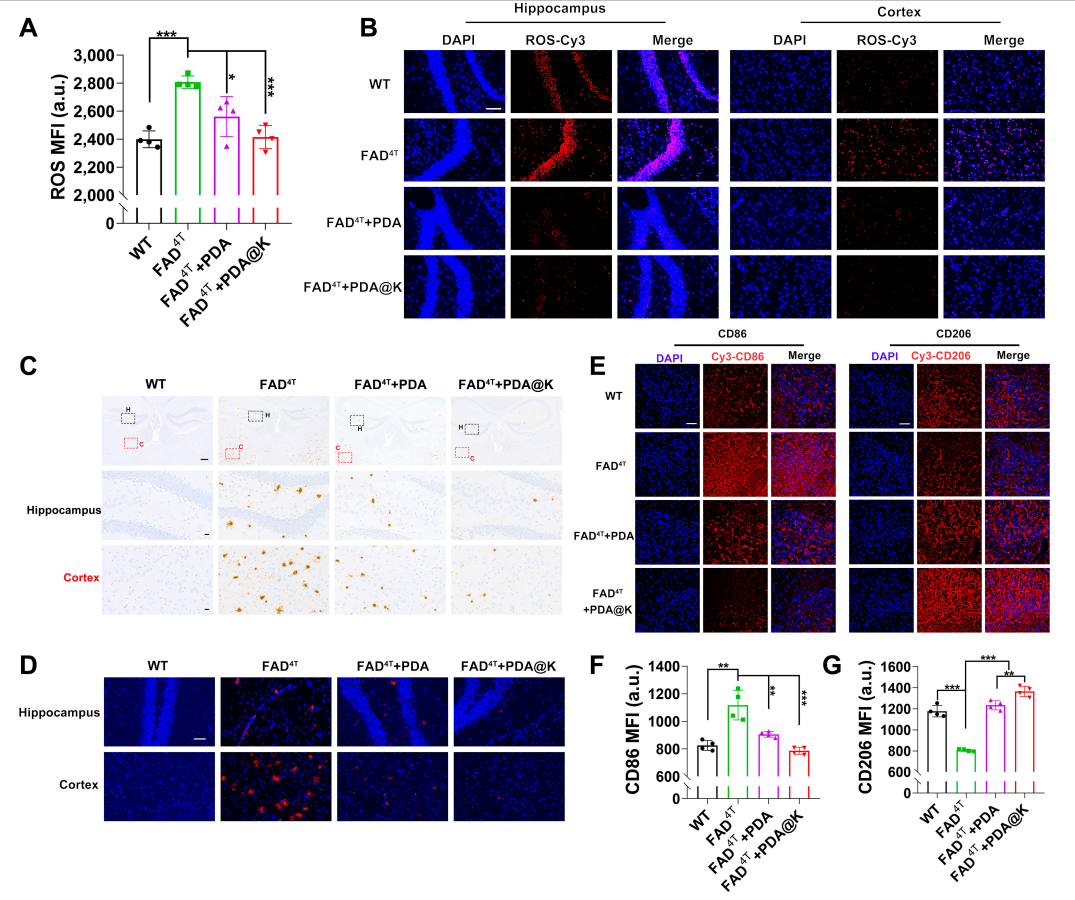
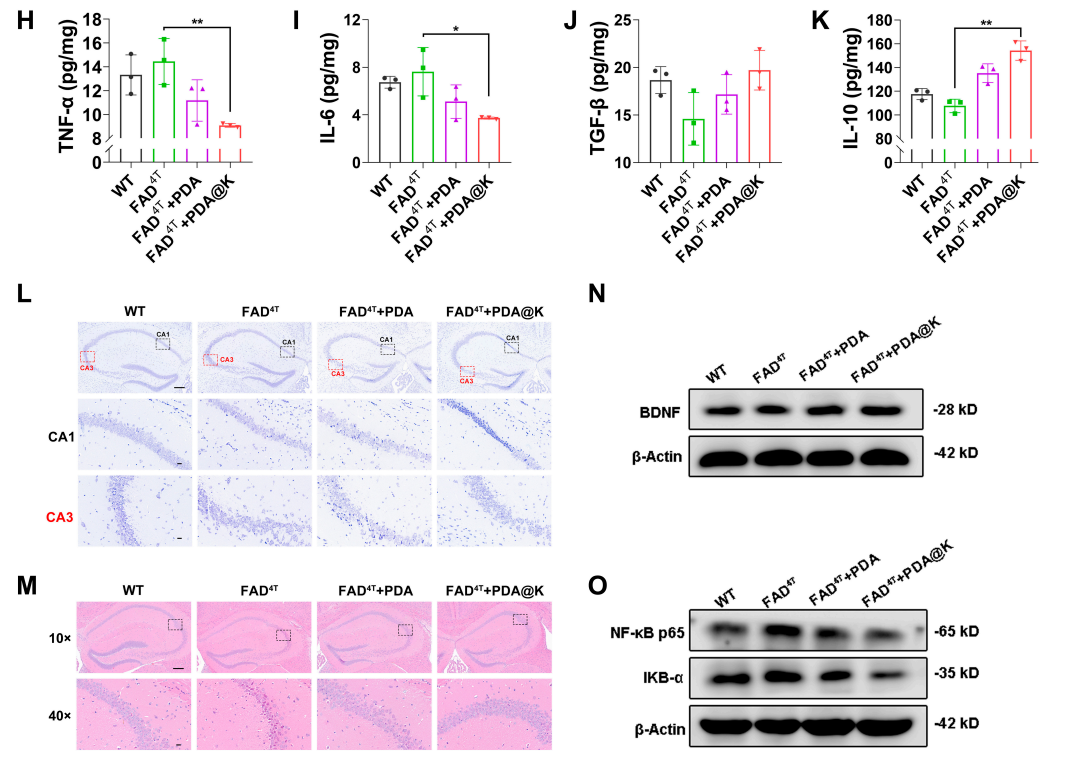
图3. FAD4T转基因小鼠体内Aβ清除、神经炎症缓解和微环境重塑
为了进一步了解NPs给药后的治疗机制,科研人员评估了PDA和PDA@K治疗后FAD4T小鼠脑的转录组特征。用PDA@K治疗后,与FAD4T组相比,共有1939个基因显著表达差异,其中997个基因表达上调(红点),942个基因下调(蓝点)。表达基因的聚类分析表明PDA@K处理极大地改变了FAD4T小鼠大脑的基因表达模式。通过基因本体(Gene Ontology, GO)分析发现,大多数差异表达基因富集于神经系统发育、胶质细胞形成、金属离子稳态、炎症反应和记忆等类别(图4)。这些数据表明,PDA@K对AD的治疗效果归因于多种信号通路的调控。这些积极的病理生理效果均有助于PDA@K-treated FAD4T转基因小鼠认知能力的恢复,PDA@K可以被认为是探索AD治疗的一种新的多管齐下的策略。

图4. NPs治疗后FAD4T转基因小鼠脑的体内转录组学分析
集萃药康自主知识产权FAD4T模型小鼠,拥有携带Swedish、Indiana突变的人源APP基因和携带M146L、L286V突变的人源PSEN1基因,具有病理表征出现早等优势,既可以很好的模拟临床AD患者的疾病表征,也能够满足相关药效需求,更多该模型相关文章在投稿或审核中,相信后续会有更多的高分文章与大家见面。除此模型之外,集萃药康还拥有3xTg、2xAD及以FAD4T为基础构建的携带人源化靶点(如hTREM2及hAPOE4等)的AD Plus小鼠模型即将上市。如需了解更多模型详情,欢迎联系您身边熟悉的销售同事或致电官方客服电话400-966-0890获取详细数据资料。
参考文献
1. Huang Q, Jiang C, Xia X, et al. Pathological BBB Crossing Melanin-like Nanoparticles as Metal-ion Chelator and Neuroinflammation Regulator against Alzheimer’s Disease[J]. Research, 2023.
1.集萃药康自主产权FAD4T小鼠模型助力老年痴呆症口服新药研究
2.老年性眼底视网膜黄斑变性(AMD)用动物实验模型验证数据说明