胶质母细胞瘤(glioblastoma, GBM)是一种普遍且高度致命的脑原发性恶性肿瘤,具有肿瘤进展迅速和频繁复发的特征。放/化疗是GBM手术后的经典疗法,但疗效和预后较差。
2021年7月,陆军军医大学卞修武,平轶芳和时雨团队在Cell Research发表了题为“Pericytes augment glioblastoma cell resistance to temozolomide through CCL5-CCR5 paracrine signaling”的文章。报道了肿瘤血管周细胞通过非屏障功能促进GBM抵抗常规化疗药替莫唑胺的分子机制,证明靶向CCL5-CCR5轴的小分子抑制剂马拉维诺与替莫唑胺联合用于治疗胶质母细胞瘤可能具有良好的应用前景。
该研究采用了集萃药康的NCG(NOD/ShiLtJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt)模型小鼠。

1、血管周细胞丰富的胶质母细胞瘤患者对替莫唑胺(TMZ)响应较差
研究者通过TMZ治疗的GBMs的癌症基因组图谱(TCGA)数据库,对胶质母细胞瘤临床样本(37例TMZ敏感,38例TMZ不敏感)进行分析发现,血管周细胞丰富的胶质母细胞瘤患者对替莫唑胺的反应性差、患者生存期更短(图1)。
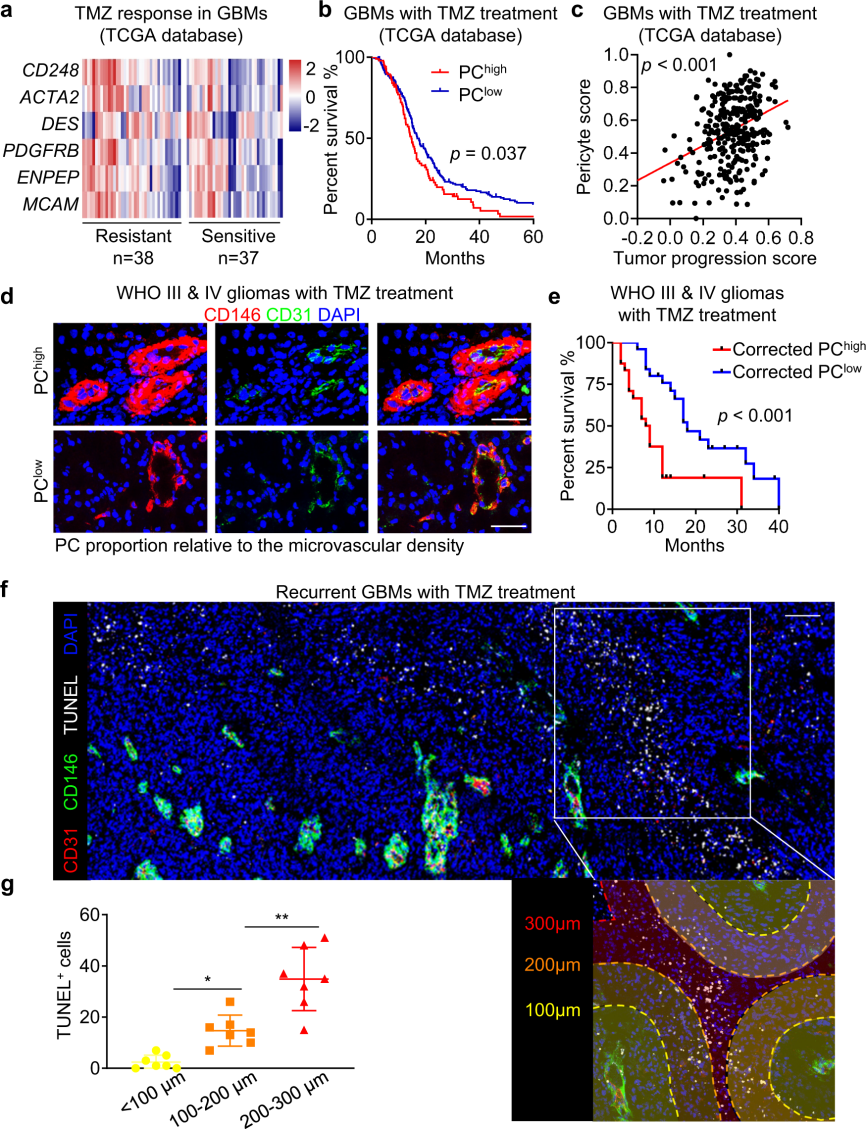
图1. 丰富的周细胞特征提示TMZ在胶质瘤患者中的治疗效果差
2、周细胞丰富的GBM异种移植中消耗周细胞可以提高TMZ的治疗效果,但几乎不影响TMZ的穿透
研究者利用Desmin-promoter-TK模型敲除胶质瘤干细胞转分化来的血管周细胞后,在NCG小鼠上移植的胶质瘤对替莫唑胺敏感性增加,肿瘤体积显著缩小(图2d)。进一步研究发现去除血管周细胞后胶质母细胞瘤移植瘤内和NCG荷瘤鼠血浆中的替莫唑胺浓度并无显著差异,说明血管周细胞促进胶质瘤细胞替莫唑胺耐药的机制并非通过屏障作用实现(图2j)。

图2. 在周细胞丰富的GBM中减少周细胞量可提高TMZ的治疗效果
3、周细胞优先分泌CCL5,与GBM细胞上表达的CCR5构成旁分泌信号
研究发现CD146+周细胞或其培养液(CM)可保护GBM细胞免受TMZ诱导的DNA损伤和细胞毒性。经RNA测序鉴定,与对照组相比,CCL5是周细胞中上调最多的细胞因子。CCL5与GBM细胞高表达的CCR5构成的旁分泌轴代表周细胞和GBM细胞之间的分子连接(图3)。
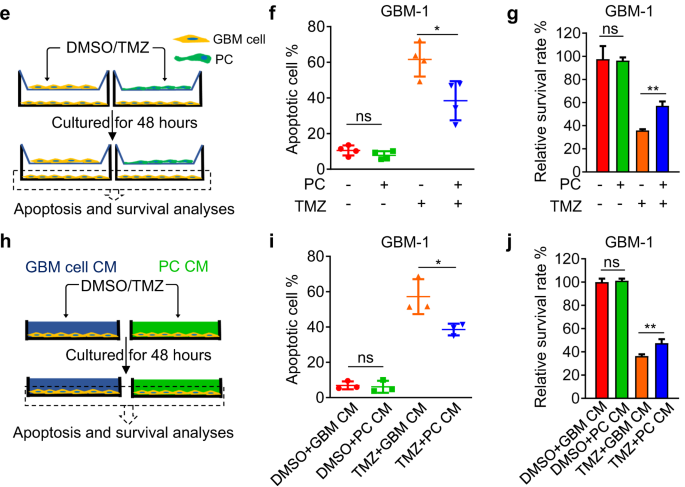
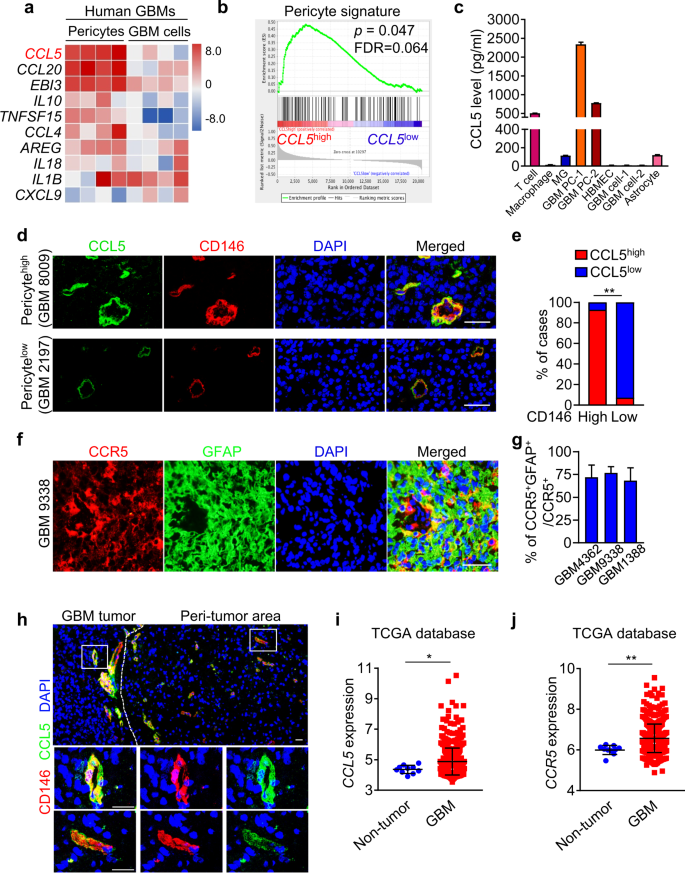
图3. CCL5-CCR5旁分泌轴代表周细胞和GBM细胞之间的分子连接
4、CCL5-CCR5信号轴通过激活DDR信号通路增强TMZ抗性
通过干扰CCL5功能或CCR5拮抗剂马拉维诺(Maraviroc, MVC)、DNA-PKcs/AKT抑制剂的使用证明CCL5-CCR5信号可激活AKT-DNA-PKcs通路增强DDR,从而削弱TMZ对GBM细胞的细胞毒作用(图4)。

图4. CCL5-CCR5旁分泌信号激活GBM细胞的DDR信号,增强TMZ抗性
5、体内研究表明CCR5拮抗剂MVC与TMZ联合使用可有效抑制GBM生长
在用NCG小鼠构建的胶质瘤PDX模型上证实MVC和TMZ联合治疗显著增强了TMZ的抑瘤作用。此外,具有CCL5高表达和CCL5低表达特征的PDX模型在对TMZ治疗的敏感性上是有差异的,CCL5高表达的PDX模型使用TMZ+MVC治疗的肿瘤抑制率与CCL5低表达的PDX模型单独使用TMZ治疗的肿瘤抑制率是接近的(图5)。

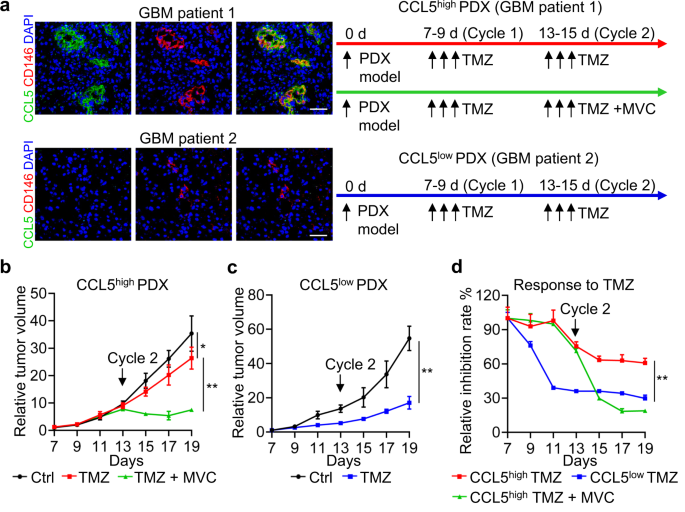
图5. MVC作为CCR5的拮抗剂,与TMZ结合可有效抑制GBM的生长
结论
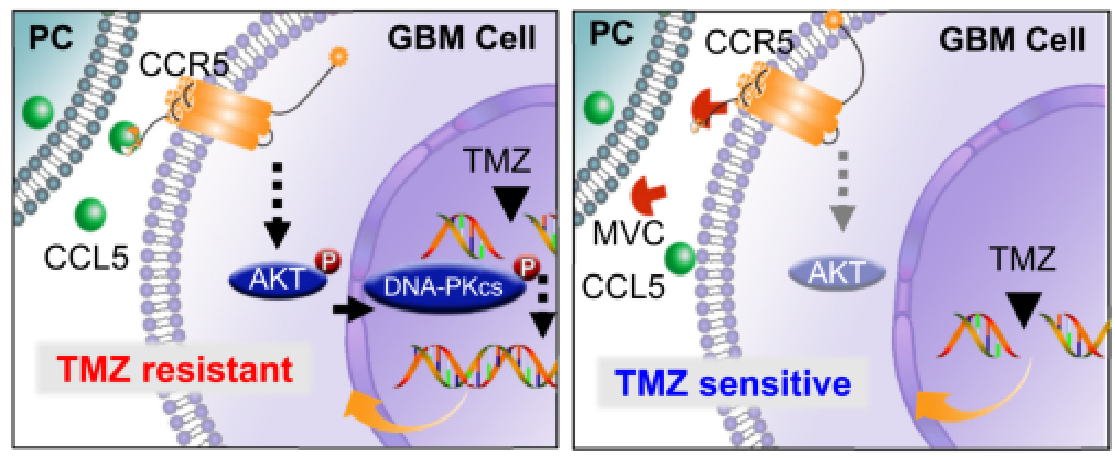
研究表明,周细胞分泌的CCL5刺激GBM细胞上的CCR5,从而促进AKT-DNA-PKcs通路的激活,增强DNA修复,从而消除TMZ诱导的GBM细胞凋亡。MVC的使用阻断了CCL5-CCR5信号并干扰了DDR,因此将GBM细胞从TMZ耐药表型逆转为TMZ敏感表型。
NCG (NOD/ShiLtJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt)是使用基因编辑技术敲除了NOD/ShiltJGpt小鼠的Prkdc及Il2rg基因而获得的重度免疫缺陷品系。适合人源肿瘤细胞移植(CDX)、人源肿瘤组织移植(PDX)以及人外周血单个核细胞(PBMC)或人源造血干细胞(CD34+ HSC)的免疫重建。