自身免疫疾病(Autoimmune disease)是机体对自身抗原发生免疫反应而攻击自身组织、器官所引起的疾病,疾病往往病程长、顽固且难以根治,对患者生存质量有极大的影响。到目前为止,已经确定了80多种自身免疫性疾病,影响了全球10%以上的人口[1],比较常见的自免疾病如系统性红斑狼疮、类风湿性关节炎、炎性肠病、哮喘及特应性皮炎等。
目前而言,大部分自免疾病的发病机制尚不明确,可能与多种因素相关,如遗传、环境、免疫等皆有一定关联,但自免疾病作为医药研发与科学研究的热门领域,相关研究自然离不开一个合适的动物模型,用于探究疾病作用机理或临床前药效测试。本文将带大家了解几种常见的自免疾病动物模型造模及应用场景。
一、系统性红斑狼疮及SLE疾病小鼠模型
系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)是一种累及全身多系统和器官的自身免疫病,其肾脏并发症狼疮性肾炎,是死亡风险增加的最强关联因素之一。与死亡率相关的其他因素,包括免疫抑制治疗后造成的感染以及心血管疾病风险的增加[2]。SLE的发病机制复杂,与遗传、性激素异常、环境因素相关,其发病常在细胞受损之后发生,如感染或严重日晒造成的细胞损伤,而一型干扰素(IFN-I)通路的激活和靶向核酸及核酸结合蛋白的自身抗体的产生,是SLE发病的起始事件。
1、B6-Trex1-KO
Trex1敲除导致小鼠自身DNA积累,组成型激活cGAS-STING信号通路,诱发多器官炎症,心肌炎表型明显。该小鼠Anti-dsDNA水平显著高于普通B6小鼠,是SLE疾病机制研究和一型干扰素通路靶点药物筛选的理想模型。
2、B6-hBAFF
转基因过表达人源BAFF,该小鼠Anti-dsDNA水平显著高于普通B6小鼠,B细胞显著激活和IgA、IgG、IgM等抗体水平升高,并且具有典型的狼疮肾炎表型。可应用于B细胞相关研究,亦适用于评价靶向B细胞的治疗药物。
3、Pristane诱导SLE小鼠
降植烷(Pristane)诱导小鼠自身免疫反应产生SLE表型,B细胞、一型干扰素通路被广泛激活,该模型使用范围较广泛。可以针对具体靶点,配合使用不同的基因人源化小鼠进行造模,进而用于评价各种抗体药物及小分子药物的临床前体内药效。
二、特应性皮炎及AD疾病小鼠模型
特应性皮炎(Atopic Dermatitis, AD)又称特应性湿疹,是最常见的慢性疾病之一,其发病率高、病程慢、反复发作且难以根治。其中最突出的临床特征是反复发作的局部瘙痒及湿疹,使患者陷入“越抓越痒”的恶性循环。此外还可能伴随皮肤干燥和干皮症等其他皮肤病,或合并全身过敏性疾病,如伴有过敏性鼻炎、哮喘等疾病,因此AD通常被认为是一种系统性的自免疾病[3-4]。目前报道的AD发病的直接诱因有很多种,包括遗传和环境因素、皮肤屏障功能障碍、微生物失衡、免疫失调、皮肤炎症与环境间的互作等等,均在特应性皮炎的发病中发挥重要作用[5]。
1、MC903诱导AD模型
MC903即卡泊三醇,是一种维生素D3的低钙类似物,广泛用于治疗银屑病。研究发现,局部使用MC903可激发小鼠上皮角质细胞高表达TSLP,促进CD4+T细胞向Th2细胞分化及激活并释放炎症细胞因子,引起小鼠产生特应性皮炎表型。
2、半抗原诱导AD模型
恶唑酮(Oxazolone, OXA)与1,2,4-二硝基氟苯(1,2,4-Dinitrofluorobenzene,DNFB)等化合物属于半抗原,能与皮肤组织蛋白结合成为完全抗原,进而激活T淋巴细胞实质成为致敏细胞,当半抗原再次进入机体,与致敏淋巴细胞接触就会引发过敏反应[6]。
三、哮喘及Asthma疾病小鼠模型
哮喘是一种异质的、高度复杂的呼吸道慢性炎症性疾病,可引起患者咳嗽、喘息、呼吸急促和胸闷等症状,严重时可危机生命。哮喘通常是由各种上皮损伤,如病毒、过敏原、细菌、空气污染物和其他环境刺激物引起的。通常在幼年发病(早发型哮喘),但也有些在成年发病(晚发型哮喘)。过敏性哮喘往往始于幼年时期,与辅助T细胞2 (Th2)反应有关。当接触过敏原后,过敏原特异性Th2细胞产生2型细胞因子(如IL-4、IL-5、IL-9、IL-13),导致气道壁上大量嗜酸性粒细胞积累,粘液分泌增多,过敏原特异性B细胞合成免疫球蛋白E (IgE)增加。
1、OVA诱导的哮喘
经典的方式是用卵清蛋白(ovalbumin, OVA)诱导。首次腹腔注射含佐剂的OVA致敏小鼠,使小鼠免疫系统获得对异种抗原反应的能力,再通过滴鼻的方式使动物再次暴露于变应原,诱导肺脏产生炎症反应并以嗜酸性粒细胞浸润、上皮细胞增厚和气道高反应性为特征。
四、多发性硬化症及MS疾病小鼠模型
多发性硬化(Multiple Sclerosis, MS)是一种罕见的、具有时间和空间多发性特点的渐进性中枢神经系统炎性脱髓鞘疾病[7],其发生和发展伴随着运动、感觉、认知功能障碍等临床症状反复发作和缓解。神经纤维外包裹有髓鞘,免疫系统错误攻击髓鞘,可导致神经功能受损,进而影响神经信号的正常传递,出现相应的症状。多发性硬化症常累及大脑、脊髓白质、皮质下结构、脑干、小脑和视神经等[8]。如果不进行及时有效的治疗,随着病情的发展,最终可导致患者肌肉协调性丧失,视力减弱、功能丧失。
1、EAE模型
MOG是一种表达在中枢少突胶质细胞和髓鞘膜表面的跨膜糖蛋白,是免疫球蛋白IgG1的一种亚型,有效的调节补体依赖性细胞毒性反应,是导致MS脱髓鞘的关键成分。一般采用MOG35-55肽段致敏C57BL/6小鼠,同时腹腔注射百日咳毒素(PTX,使血管通透性增加,T细胞更易通过血脑屏障作用于神经髓鞘)建立EAE模型。
五、炎症性肠病及IBD疾病小鼠模型
炎症性肠病(Inflammatory Bowel Disease, IBD)是一类病因尚不明确的慢性、特发性消化道疑难杂症,主要包括溃疡性结肠炎(Ulcerative Colitis, UC)和克罗恩病(Crohn's Disease, CD)两种疾病表型,临床上,IBD病人普遍存在腹痛、腹泻、低烧、营养不良等症状。目前,针对IBD的致病机制仍然没有统一的结论,普遍认为遗传、免疫、环境、微生物是诱发IBD发病的四大因素。
1、DSS诱导模型—表型上与UC相似,可作为急性/慢性肠炎模型
2、DNBS诱导模型—表型上与CD相似,可作为急性肠炎模型
3、IL-10 KO模型—自发肠炎模型,发病率、发病周期与环境相关
六、类风湿性关节炎及RA疾病小鼠模型
类风湿性关节炎(Rheumatoid Arthritis, RA)是一种不可治愈的系统性自身免疫性疾病。RA主要影响小关节,表现为关节炎症、肿胀、发烧、疼痛和僵硬,除关节症状外,还可出现关节周围或内脏的类风湿结节,并可有心、肺、眼、肾、周围神经等病变[9]。
1、CIA诱导模型
胶原蛋白是细胞外间质成分,分为Ⅰ型、Ⅱ型和Ⅲ型,其中Ⅱ型胶原大量存在于关节软骨中。当用异源性Ⅱ型胶原来免疫动物,可诱导体内产生针对关节软骨中的Ⅱ型胶原的自身免疫反应。
2、CAIA诱导模型
CAIA属于CIA模型的扩展,通过靶向Ⅱ型胶原蛋白各种表位的抗体混合物来诱导关节炎的发生,可在短时间快速发病,发病率、可重复性及稳定性较高。
七、银屑病及Psoriasis疾病小鼠模型
银屑病俗称牛皮癣,是一种由遗传、免疫、感染等多种因素诱发的慢性自身免疫性皮肤疾病[10]。感染和物理损伤等触发因素刺激树突状细胞(DCs)释放促炎因子,并促进产生大量的银屑病细胞因子。此外,皮肤浸润细胞通过产生IL-17参与疾病的发展,Treg细胞和Th17/Treg平衡也在银屑病的发病过程中发挥重要作用[11]。
1、IMQ诱导模型
咪喹莫特(IMQ)是Toll样受体(TLRs)的配体,能够强烈激活免疫系统。每日使用IMQ涂抹近交系小鼠(如BALB/c)背部或耳部的皮肤,可诱导形成类似银屑病斑块的皮肤病变。
2、K14-IL-17A自发模型
通过将IL-17A转基因小鼠与K14-Cre鼠杂交产生K14-IL-17A小鼠,小鼠有明显的皮肤炎症,在免疫学上与人类银屑病较为相似,也具有人类银屑病的许多标志性特征。
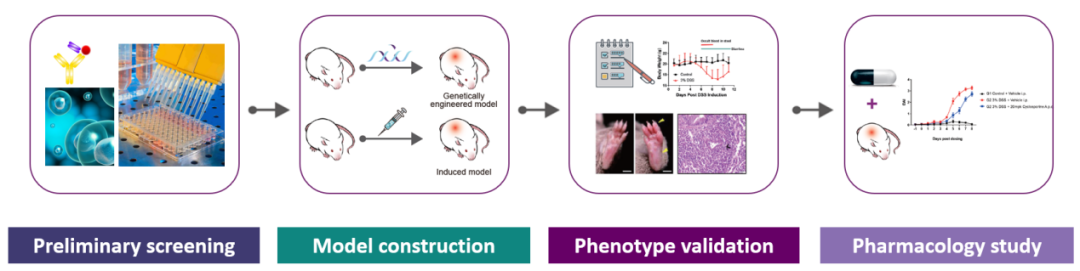
自免药物临床前一站式服务平台
集萃药康自免平台除提供动物模型外,并可定制药物开发临床前一站式服务,主要聚焦系统性红斑狼疮、炎性肠病、多发性硬化症、银屑病、特应性皮炎、类风湿性关节炎等疾病领域。更多疾病模型信息欢迎咨询!
参考文献
【1】Xinhua Yu 1, Frank Petersen.Autoimmun Rev. 2018 May;17(5):473-479. doi: 10.1016/j.autrev.2018.03.001. Epub 2018 Mar 8.
【2】Kaul, A., Gordon, C., Crow, M. et al. Systemic lupus erythematosus. Nat Rev Dis Primers 2, 16039 (2016).
【3】Weidinger, S. and N. Novak, Atopic dermatitis. The Lancet, 2016. 387(10023): p. 1109-1122.
【4】Garmhausen, D., et al., Characterization of different courses of atopic dermatitis in adolescent and adult patients. Allergy, 2013. 68(4): p. 498-506.
【5】Ständer, S., Atopic Dermatitis. The New England journal of medicine. 384(12): p. 1136-1143.
【6】李覃,高颖,曹波,等.变态反应性接触性皮炎体内外模型制作探讨[J].武警医学, 2013,24(10):849-852.
【7】王佳颖,阮邹荣,江波.治疗多发性硬化症药物临床试验现状及展望[J].中国现代应用药学,2022,39(18):2405-2411.
【8】Dendrou CA, Fugger L, Friese MA. Immunopathology of multiple sclerosis. Nat Rev Immunol. 2015;15(9):545-558.
【9】Ding, Q., et al., Signaling pathways in rheumatoid arthritis: implications for targeted therapy. Signal Transduct Target Ther, 2023. 8(1): p. 68.
【10】 Boehncke WH, Schön MP. Psoriasis. Lancet. 2015 Sep 5;386(9997):983-94.
【11】Hu P, Wang M, Gao H, Zheng A, Li J, Mu D, Tong J. The Role of Helper T Cells in Psoriasis. Front Immunol. 2021 Dec 15;12:788940.