帕金森病(Parkinson’s disease,PD)是第二常见的神经系统变性病,仅次于阿尔茨海默病。PD的主要临床行为学特征包括静止性震颤、强直、运动迟缓和步态异常,临床病理特征主要表现为:中脑黑质致密部(Substantia nigra pars compacta, SNpc)的多巴胺能神经元(Dopamine, DA)进行性丢失和胞浆中包涵体物质路易小体(Lewy body,LB)形成。PD多见于老人群体,平均发病年龄为60岁左右。在中国,目前有将近300万的PD患者,是世界上该病患者最多的国家,随着老龄化问题的日趋严重,预计到2030年,中国PD患者将激增至500 万人左右,预计超过全球患者比例的50%。
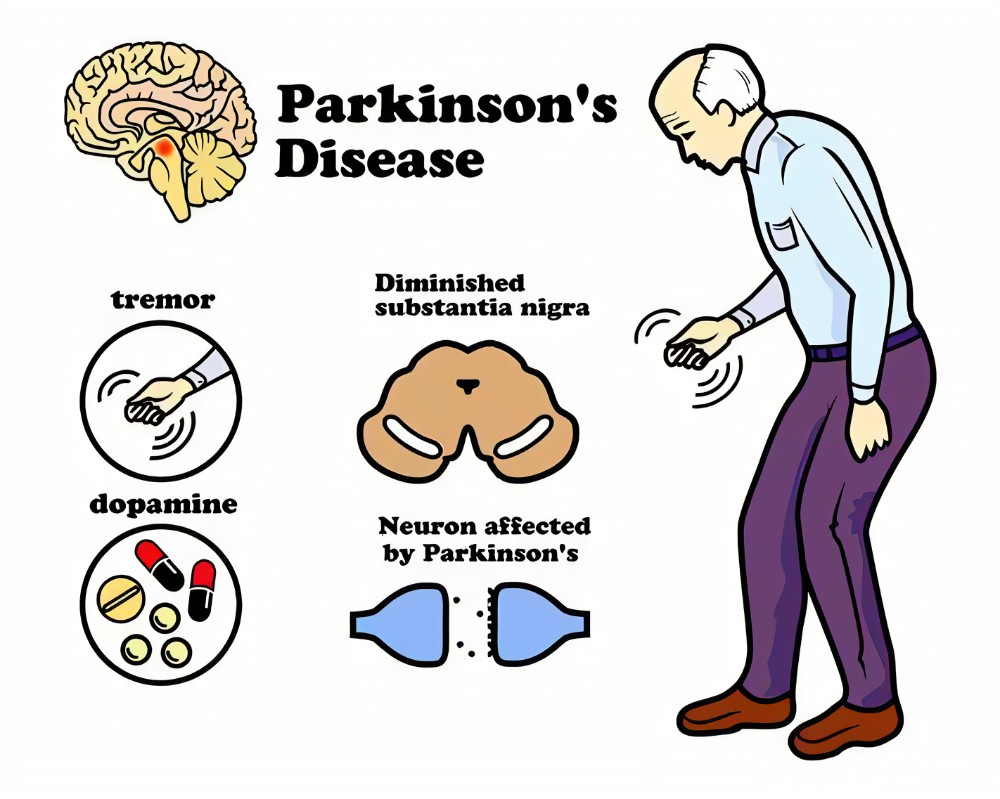
图一:帕金森病的临床症状及病因(图片来源:parkinson's disease may be stopped (askdrray.com))
PD的发病机制十分复杂,PD典型的病理改变是形成路易体,而α-突触核蛋白(α-synuclein,α-syn)正是LB的主要成分,α-syn可能从多个方面影响PD发病机制,原因通常归咎于其异常的可溶性低聚物构象,亦称为淀粉样纤维化。α-突触核蛋白(α-syn)是一种在中枢神经系统突触前及核周表达的可溶性蛋白质,同时对突触可塑性、囊泡动力学和多巴胺合成具有潜在作用,病理性的α-syn与路易小体的形成及多巴胺能神经元的死亡密切相关。因此α-syn被认为是一些神经退行性疾病的分子标志,α-syn在各种因素的影响下异常表达和聚集,这一过程产生的氧化应激等生化反应和寡聚体中间构象等均在帕金森发病过程中起着重要的作用。生理状态的α-syn为无序单体或螺旋折叠的四聚体,病理状态下为聚合状态,即毒性α-突触核蛋白。在帕金森病中,这些包涵体分布于延髓、嗅球、蓝斑、黑质,并在较小程度上分布于皮质的各个区域。
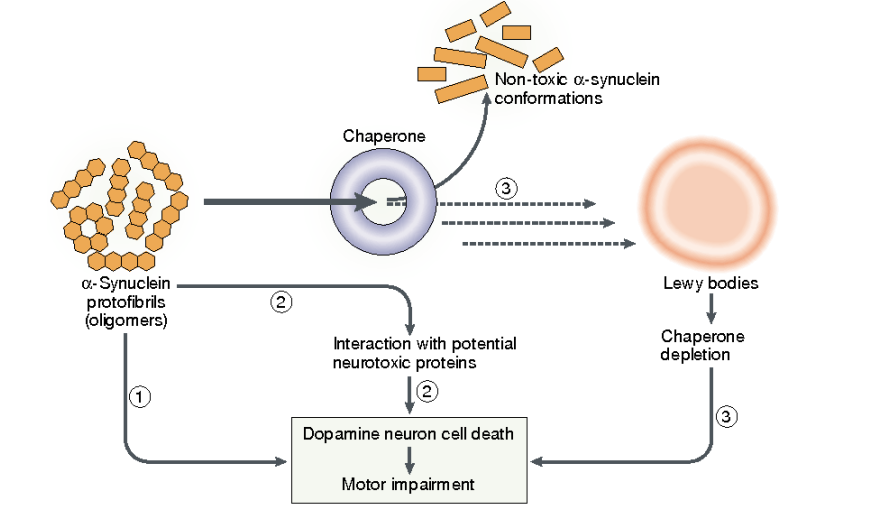
图二:α-突触核蛋白在帕金森病中的作用(图片来源:Nature Reviews Neuroscience volume 4, pages 727–738 (2003),The role of α-synuclein in Parkinson's disease: insights from animal models | Nature Reviews Neuroscience)
编码α-突触核蛋白的基因SNCA具有三个主要基因突变位点:A53T(Ala-Thr),A30P(Ala-Pro)和E46K(Glu-Lys)。这些突变都可以破坏蛋白原有分子空间结构和稳定性,致使α-突触核蛋白无法正常降解,异常聚集形成淀粉样结构(纤维、路易小体),从而引起神经元变性。
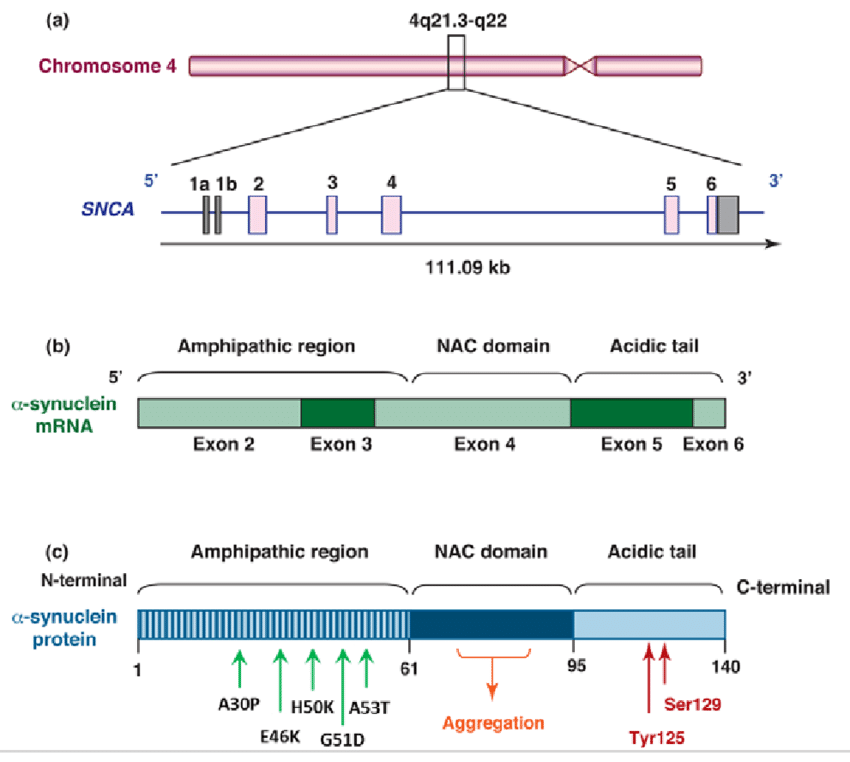
图三:α-syn在帕金森病发病机制中起着重要作用。(a, b) α-syn由SNCA基因编码,位于4号染色体上。
该蛋白由140个氨基酸组成。(c) α-syn不同结构域示意图以及家族突变A30P、E46K、H50Q、G51D和A53T在N端结构域的定位。
帕金森病药物开发现状——未能满足临床需求
目前,用于治疗帕金森的药物治疗可以分成抗胆碱能药、金刚烷胺、多巴胺替代疗法、多巴胺受体激动剂、单胺氧化酶-B抑制剂、COMT抑制剂、腺苷A2A受体拮抗剂六大类。然而目前这些药物仅以对症治疗为主,尚缺乏能够延缓或阻止疾病进展的PD药物,因此不断开发新型PD治疗药物至关重要。在PD药物研发的道路上,选择合适的小鼠模型进行临床前药效评价是推进新药开发的第一助力。

图四:2015-2019年全球抗帕金森药物市场
集萃药康针对人源SNCA的A53T家族突变位点,自主研发了B6-hSNCA A53T转基因模型,该模型可用于帕金森病治疗药物的筛选、安全性评价及发病机制研究。
初步验证数据展示:
1.B6-hSNCA A53T小鼠行为学检测
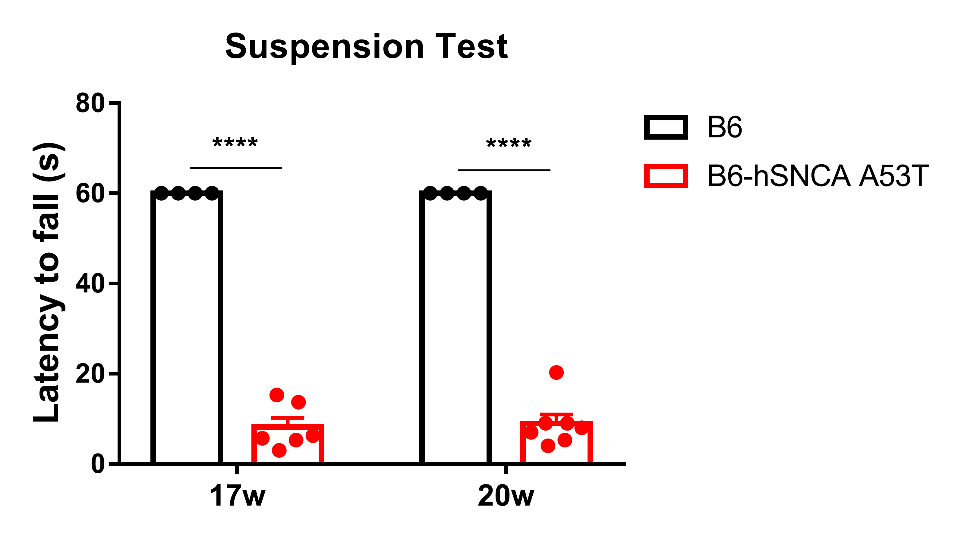
图五: B6-hSNCA A53T小鼠17w、20w悬挂测试。
实验结果显示:与B6小鼠相比,17w 、20w B6-hSNCA A53T小鼠在挂时间显著降低。

图六:B6-hSNCA A53T小鼠17w、20w抓力测试。
实验结果显示:与B6小鼠相比,17w、20w B6-hSNCA A53T小鼠四肢肌肉力量显著降低。

图七:B6-hSNCA A53T小鼠17w、20w疲劳旋转棒测试。
实验结果显示:与B6小鼠相比,17w、20w B6-hSNCA A53T小鼠在棒时间显著降低。
以上行为学测试结果说明B6-hSNCA A53T模型在4月龄时即呈现明显的运动功能障碍(肌肉力量下降,运动平衡性失调等),且呈年龄依赖性。
2. B6-hSNCA A53T小鼠病理检测
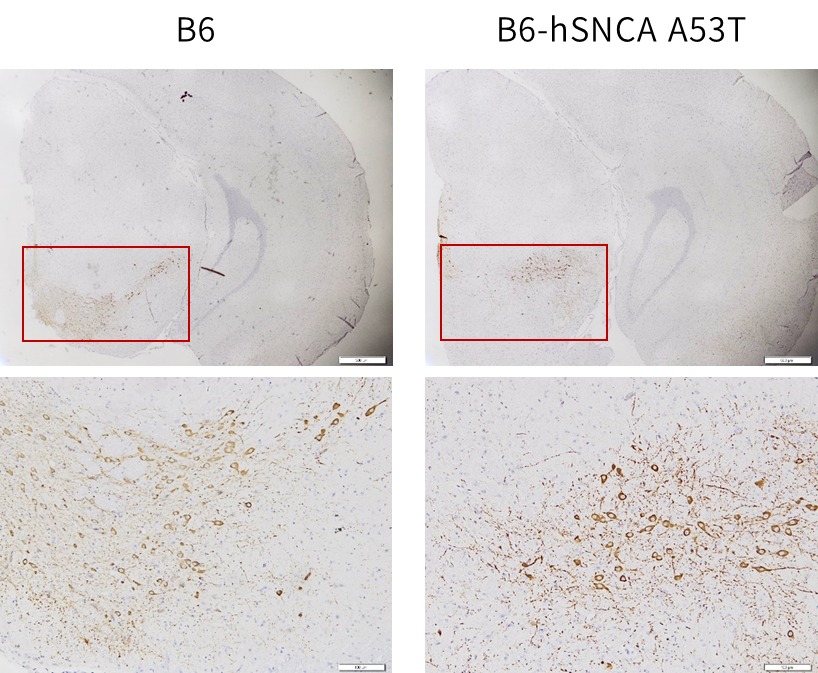
图八:B6-hSNCA A53T小鼠20w脑区TH+神经元检测。
B6-hSNCA A53T小鼠在20w时即可检测到TH+神经元大量丢失,且伴随神经元形态异常(胞体核周质固缩)。
B6-hSNCA A53T模型将于8月上线小鼠商城,敬请期待!