近年来,非酒精性脂肪肝疾病(NAFLD)在全球呈现高流行趋势。根据 2018 年的流行率统计,全球的患病率达25%,越来越引起人们重视[1]。纵观国内,我国 NAFLD 的流行率也由 20 世纪初的 23.8% 攀升至 2018 年的 29.6%,预计到 2030 年,我国受 NAFLD 影响的人口将达 3.1 亿,NAFLD 也将成为中国常见的肝癌、肝衰竭以及肝移植的重要病因,给社会带来沉重的公共卫生负担[2]。
2022 年 2 月,相关研究团队在 Hepatology 杂志上发表了一项研究成果:FGF4 protects the liver from non-alcoholic fatty liver disease by activating the AMPK-Caspase 6 signal axis,该研究发现 FGF4 是一种肝脏内源性保护因子及 NAFLD 的新型生物标记物,并证明重组 FGF4 蛋白可显著遏制代谢性肝脏炎症进展及非酒精性脂肪性肝炎(NASH)相关肝纤维化的病理进展,为日益严峻的 NAFLD/NASH 提供了一种全新的诊疗分子和药物干预策略。
今天我们就着重了解 NAFLD/NASH 的相关知识点
NAFLD/NASH 的病程发展和特征
NAFLD/NASH 治疗药物开发现状
如何选择合适的 NASH 研究模型
NAFLD 的病程发展
NAFLD 是无酗酒史患者肝脏中出现大量脂肪积累的病症,包括单纯性脂肪肝(SFL)、NASH 及其相关肝硬化。NASH 是 NAFLD 中更严重的一种形式,不仅表现为肝脏脂肪变性,还伴随出现肝小叶内炎症、肝细胞气球样病变以及纤维化。
NAFLD 的疾病发展谱极为广泛,囊括最初可逆转的肝脂肪变性和 NASH,以及后期不可逆的纤维化、肝硬化乃至最终的肝细胞癌(HCC)。一旦进展为肝硬化/肝癌,将无法通过常规药物逆转,只能进行肝移植。
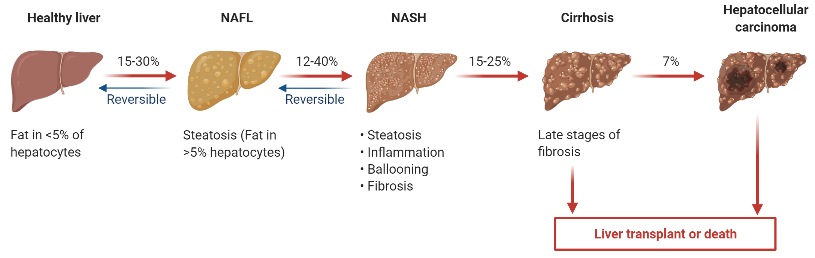
图 1:NAFLD 的病程发展[3]
NAFLD/NASH 的发生多伴随代谢紊乱特征
NAFLD/NASH 患者多合并糖尿病、肥胖、高血压、高血脂以及代谢综合征。这些代谢相关疾病也是 NAFLD/NASH 的危险因素。其中 2 型糖尿病和肥胖是主要的两个危险因素。全球一半以上 2 型糖尿病患者合并 NAFLD。肥胖人群的 NAFLD 发病率更高,肥胖合并 NAFLD 患者的心血管疾病(CVD)风险和纤维化程度也更高。
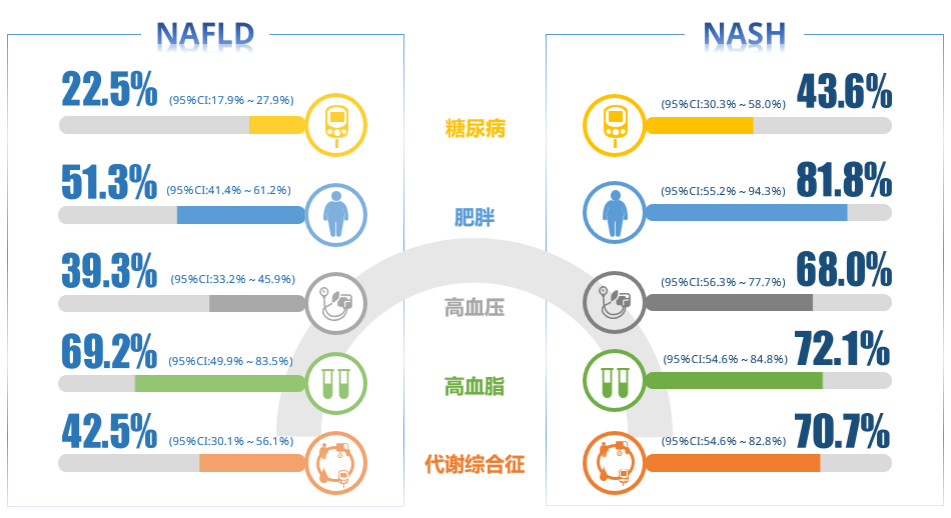
图 2:NAFLD/NASH 患者多合并代谢相关疾病[4]
NAFLD/NASH 治疗药物开发任重道远
NAFLD/NASH 治疗一方面是通过改变生活方式(如改善饮食结构,减少高热量食物的摄入,适当运动等)改善病症,但据统计,临床上只有 50% 左右的患者可以成功减重并且持续减轻体重。因此该方式并不适用于所有人群。另一方面就是通过药物治疗,截止目前,除了印度药物管理局(DCGI)批准上市的 PPARα/γ 双重激动剂可用于治疗非肝硬化性 NASH 患者,尚无其他药物获得包括美国食品药品监督管理局(FDA)在内的其他药监局的批准。奥贝胆酸(OCA)是一种法尼醇 X 受体(FXR)激动剂,FXR在脂肪代谢中起到重要调控作用。OCA 虽然临床数据积极,但皮肤瘙痒的副作用以及有效剂量高出了其他适应症,说明 OCA 并不是理想的 NASH 治疗药物,降低药物剂量组合其他疗法有可能是其发展的前景。
图 3:药物研发流程
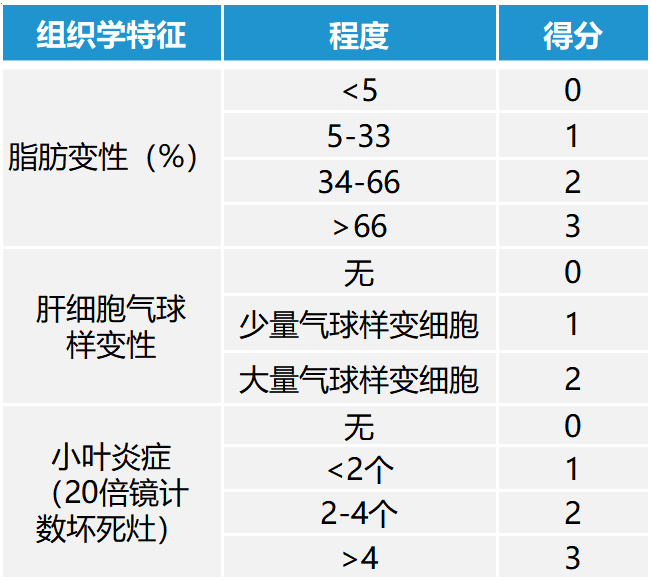
NASH 治疗药物的开发任重道远,选择合适的 NASH 模型至关重要。复刻人类 NASH 病症的模型一方面需要满足有肥胖、高血糖、高胰岛素血症、高血脂等代谢紊乱特征,另一方面需要表现出肝脏组织病理学特征。肝脏组织病理评分可参造临床 NAS(NAFLD activity score)评分系统,根据脂肪变性、肝细胞气球样变性、小叶炎症三个维度评分,NAS ≥ 5 分时被判定可作为 NASH 评估模型。
表 1:临床 NAS 评分系统(0~8)
应用于 NASH 治疗药物评价的新模型开发-野化鼠 750
野化鼠生存于真实的自然环境中,需要适应各种环境压力,且没有经过人工选择,因此野化鼠相较于传统的实验室小鼠模型具有更丰富的遗传多样性。事实上,也有相关研究报道,野化小鼠具有不同的疾病易感性[5-6]。因此,利用野化鼠进行临床前研究或许能更好的模拟人体生理和疾病状态,从而降低药物在临床前和临床研究之间的不一致性,更好地反映出药物在人体的真实效果以及不良反应。
集萃药康以野外捕捉的野生小鼠作为供体,通过不断与近交系小鼠(C57BL/6J)回交和筛选,培育出仅有一条染色体与受体近交系不同的新的近交系。当前,集萃药康已获得了不同来源野化鼠 1 号染色体置换系小鼠,经过体重、血糖、血生化、行为学等表型初筛,发现了一些对相应疾病易感的小鼠品系。
野化鼠 750(品系全称:B6-Chr1YP1,品系编号:D000750)引入了杨浦地区某野化小鼠 1 号染色体,相比近交系小鼠具有基因多样性。野化鼠 750 是一个代谢易感品系,常规饮食条件下 8 周龄后即表现出自发肥胖表型,血脂、瘦素、胰岛素水平显著升高,血糖呈现轻度升高,表现出代谢紊乱特征。
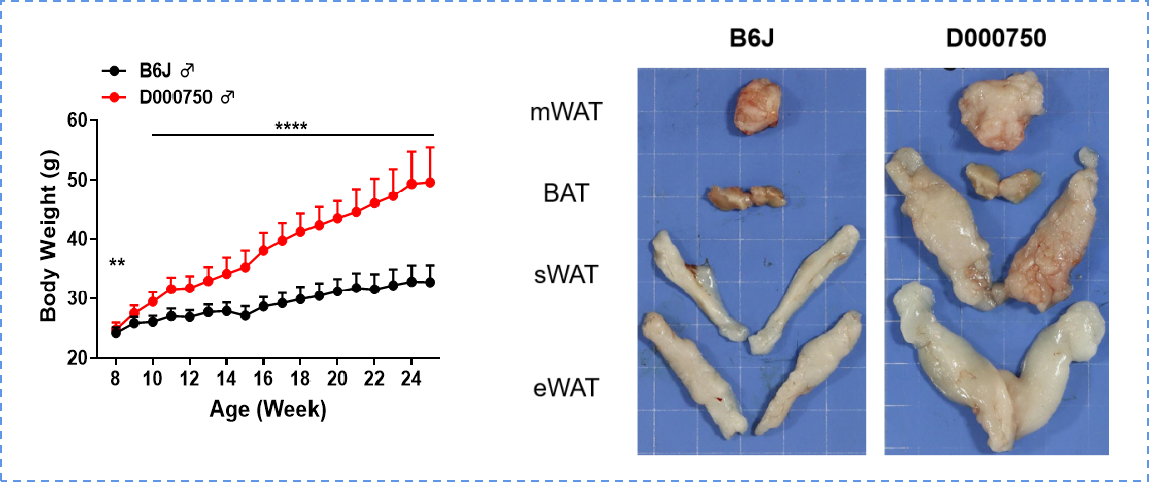
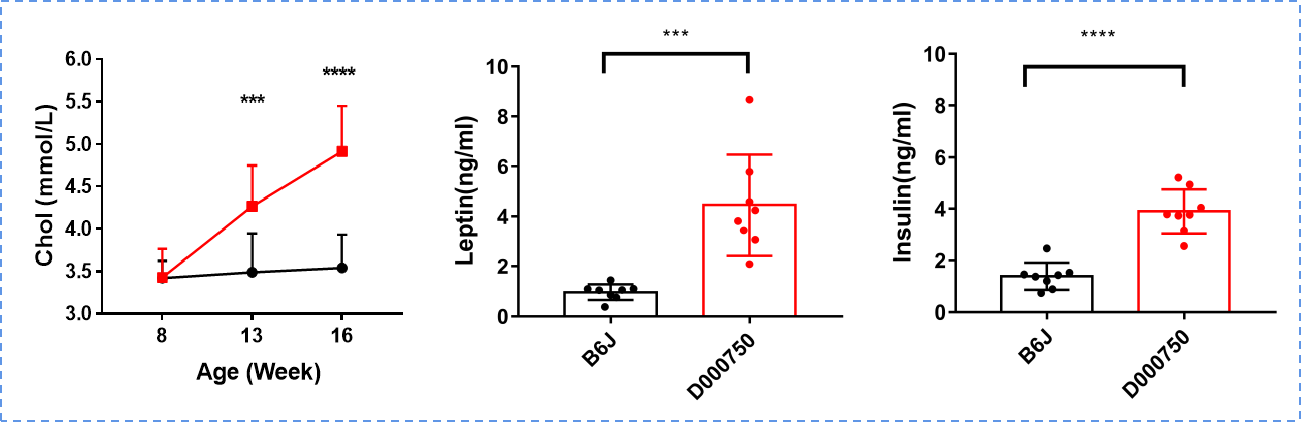
图 4:750 小鼠表型观察
750 小鼠 8 周龄后呈现自发肥胖,体重显著高于 B6 小鼠,且胆固醇、瘦素、胰岛素水平显著升高。750 小鼠各部分脂肪组织明显多于 B6 小鼠。肠系膜(m)、皮下(s)、附睾(e)、白色脂肪组织(WAT)、棕色脂肪组织(BAT)。
野化鼠 750 常规饮食条件下 8 周龄后表现出自发肥胖表型,随周龄增加肥胖程度加重,在26 周龄时可观察到明显的脂肪肝表型。西方饮食(WD)诱导下,进一步加速 NASH 病症出现,在 WD 喂养 20 周后,野化鼠 750 表现出经典的 NASH 症状,包括脂肪变性、炎症等表型,同时还表现出中等程度纤维化。通过临床 NAS 评分系统评估,评分 > 7 分,判定可用作 NASH 研究。纤维化评分约 2 分,可用作抗纤维化药物的评估。
野化鼠 750 应用于脂肪肝研究,疾病特征更贴合人体病程
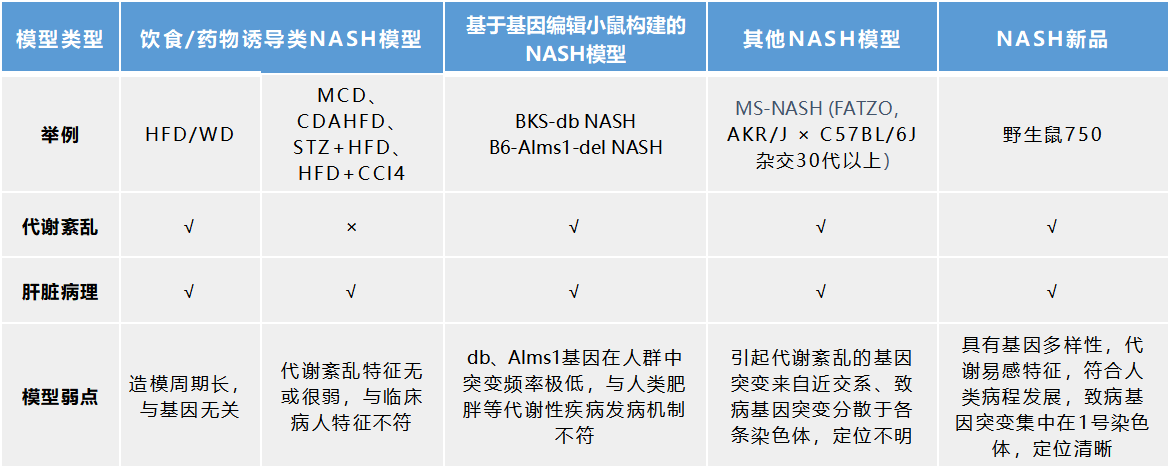
与现有的 NASH 模型相比,野化鼠 750 吃得多(摄食量显著增加)动得少(氧耗和活动度降低),符合人类肥胖、脂肪肝等病程发展。基于野化鼠 750 本身具有代谢易感特征,在高脂饮食/WD 诱导下能加速 NASH 表型的出现。且野化鼠 750 引起代谢紊乱的基因突变来自自然界,致病基因突变集中在 1 号染色体,定位清晰,有利于新基因发现和机制探索。
因此,750 小鼠是研究脂肪肝疾病(NAFLD/NASH)的一个更合适的选择,并且可用于肥胖、糖尿病、血脂代谢紊乱、心血管疾病等研究以及减重、降糖、降脂等药物的药效评价。
表 2:野化鼠 750 与以往常用 NASH 模型的比较
参考文献:
1. Zobair Younossi, Frank Tacke, Marco Arrese, et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology, 2019.
2. Jianghua Zhou, Feng Zhou, Wenxin Wang, et al. Epidemiological Features of NAFLD From 1999 to 2018 in China. Hepatology. 2020.
3. Stefan N, et al. Non-alcoholic fatty liver disease: causes,diagnosis, cardiometabolic consequences, and treatment strategies. Lancet Diabetes Endocrinol, 2019.
4. 非酒精性脂肪性肝病防治指南(2018年更新版). 实用肝脏病杂志. 2018.
5. Xu FY, et al. Genome Sequencing of Chromosome 1 Substitution Lines Derived from Chinese Wild Mice Revealed a Unique Resource for Genetic Studies of Complex Traits. G3 (Bethesda). 2016.
6. Phifer-Rixey M and Nachman MW. Insights into mammalian biology from the wild house mouse Mus musculus. eLife. 2015.